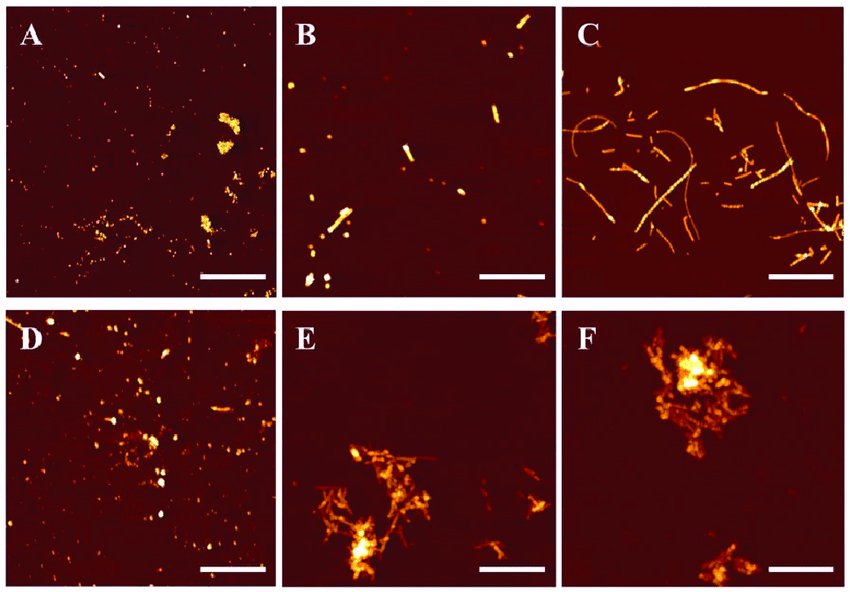
 Aggregati amiloide incubati senza rame a 1 ora (A), 6 ore (B) e 24 ore (C), e con rame agli stessi momenti (D-E-F). Fonte: Zoya Leonenko DOI
Aggregati amiloide incubati senza rame a 1 ora (A), 6 ore (B) e 24 ore (C), e con rame agli stessi momenti (D-E-F). Fonte: Zoya Leonenko DOI
È diventato evidente di recente che le interazioni tra rame e amiloide-β (Aβ) hanno un impatto neurotossico sul cervello dei pazienti con morbo di Alzheimer (MA). I ricercatori del Korea Advanced Institute of Science and Technology (KAIST) hanno riferito una nuova strategia per alterare la neurotossicità del MA usando un reagente chimico progettato razionalmente.
Questa strategia, sviluppata dalla prof.ssa Mi Hee Lim del Dipartimento di Chimica, può modificare la sfera di coordinazione del rame che si lega all'Aβ, inibendo in modo efficace il legame tra rame e Aβ e alterandone l'aggregazione e la tossicità. Il loro studio è stato pubblicato il mese scorso su PNAS.
I ricercatori hanno sviluppato una piccola molecola che è in grado di interagire direttamente con la sfera di coordinazione dei complessi rame-Aβ, in seguito a cambiamenti via coniugazione covalente, ossidazione, o entrambi in condizioni aerobiche. Il team di ricerca ha semplicemente usato la chimica del rame-diossigeno (o ossigeno molecolare o ossigeno biatomico o ossigeno diatomico) per progettare un reagente chimico.
Resta molto impegnativo rispondere alla domanda di come avvengono i cambiamenti al peptide [amiloide] per mezzo di una piccola molecola. Il sistema include metalli di transizione e proteine amiloidogeniche ed è piuttosto eterogeneo, dal momento che cambiano in continuazione.
È fondamentale controllare attentamente diverse variabili, come la presenza di diossigeno e del tipo di ioni di metalli di transizione e di proteine amiloidogeniche, per identificare i meccanismi sottostanti e puntare le specificità del reagente chimico.
Il team di ricerca ha impiegato vari metodi biofisici e biochimici per stabilire i meccanismi dei cambiamenti sulla sfera di coordinazione dei complessi rame-Aꞵ. Tra questi, sono state analizzati i cambiamenti al peptide [amiloide] usando principalmente la spettrometria di massa a ionizzazione elettronebulizzata.
La spettrometria di massa (MS) è stata usata per verificare tali modifiche al peptide, calcolando lo spostamento della massa esatta. Il gruppo di ricerca ha anche eseguito la dissociazione indotta da collisione (CID, collision-induced dissociation) dello ione bersaglio rilevato dalla MS per individuare quale amminoacido residuo è specificamente modificato. La CID frammenta il legame ammidico che si trova tra i residui di aminoacido. Questa analisi frammentale ci permette di identificare i siti specifici di modificazioni del peptide.
I complessi di rame e Aβ rappresentano una connessione patologica tra gli ioni metallici e l'Aβ nel MA. Recenti scoperte indicano che il rame e l'Aβ possono contribuire direttamente alla neurodegenerazione producendo oligomeri tossici di Aβ e specie reattive dell'ossigeno.
La prof.ssa Lim ha detto:
“Questo studio ci dà la prima evidenza sperimentale che il 14° residuo di istidina nei complessi rame-Aβ può essere specificamente modificato attraverso la coniugazione covalente o l'ossidazione, o entrambi. Considerando le implicazioni neurotossiche delle interazioni tra rame e Aβ, tali modifiche alla sfera di coordinazione del rame nell'Aβ potrebbero alterarne efficacemente le proprietà e la tossicità”.
“Questo studio multidisciplinare con enfasi su approcci, reattività e meccanismi, può aprire potenzialmente una nuova strada per sviluppare farmaci candidati che contrastano le malattie neurodegenerative”.
Fonte: Korea Advanced Institute of Science and Technology (> English text) - Traduzione di Matteo Pellizzari.
Riferimenti: Mechanistic approaches for chemically modifying the coordination sphere of copper–amyloid-β complexes.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.




 Associazione Alzheimer OdV
Associazione Alzheimer OdV