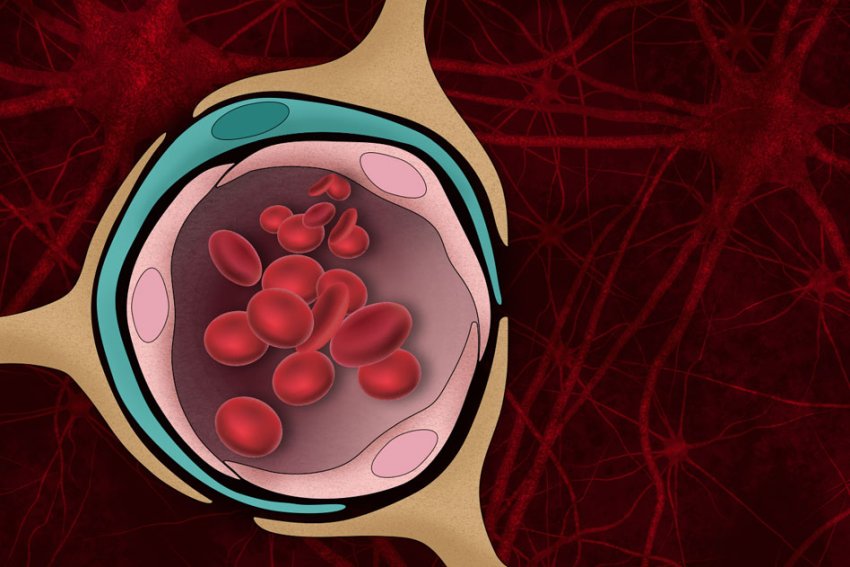
 La barriera emato-encefalica, che se è stretta come di norma impedisce alle molecole dannose di entrare nel flusso sanguigno del cervello, può essere danneggiata dagli aggregati proteici che formati dall'Alzheimer (Immagine: Christine Daniloff, MIT)
La barriera emato-encefalica, che se è stretta come di norma impedisce alle molecole dannose di entrare nel flusso sanguigno del cervello, può essere danneggiata dagli aggregati proteici che formati dall'Alzheimer (Immagine: Christine Daniloff, MIT)
Le placche di amiloide-beta (Aβ), gli aggregati proteici che si formano nel cervello dei malati di morbo di Alzheimer (MA), interrompono molte funzioni cerebrali e possono uccidere i neuroni. Possono anche danneggiare la barriera emato-encefalica, lo sbarramento di norma molto stretto che impedisce alle molecole dannose presenti nel flusso sanguigno di entrare nel cervello.
Gli ingegneri del MIT hanno ora sviluppato un modello di tessuto che imita gli effetti dell'Aβ sulla barriera emato-encefalica e lo hanno usato per dimostrare che questo danno può portare delle molecole (come la trombina, un fattore di coagulazione normalmente presente nel flusso sanguigno) a entrare nel cervello e causare ulteriori danni ai neuroni di MA.
"In questo modello abbiamo dimostrato chiaramente che l'Aβ secreta dalle cellule del MA può effettivamente compromettere la funzione della barriera e, una volta compromessa, vengono secreti dei fattori nel tessuto cerebrale che possono avere effetti negativi sulla salute dei neuroni", afferma Roger Kamm, professore distinto di ingegneria meccanica e biologica al MIT.
I ricercatori hanno anche usato il modello di tessuto per dimostrare che un farmaco che ripristina la barriera emato-encefalica può rallentare la morte cellulare dei neuroni di MA.
Kamm e Rudolph Tanzi, professore di neurologia di Harvard e del Massachusetts General Hospital, sono gli autori senior dello studio, apparso ieri 12 agosto nella rivista Advanced Science. Yoojin Shin postdottorato del MIT è il primo autore della ricerca.
Rottura della barriera
Le cellule dei vasi sanguigni che compongono la barriera emato-encefalica hanno molte proteine specializzate che le aiutano a formare giunzioni strette: strutture cellulari che fungono da forte sigillo tra le cellule.
I pazienti di MA spesso subiscono danni ai vasi sanguigni cerebrali causati da proteine Aβ, un effetto chiamato 'angiopatia cerebrale amiloide' (CAA, cerebral amyloid angiopathy). Si ritiene che questo danno consenta alle molecole dannose di penetrare nel cervello più facilmente. Kamm ha deciso di studiare questo fenomeno, e il suo ruolo nel MA, modellando tessuto cerebrale e vasi sanguigni su un chip microfluidico.
"Quello che abbiamo cercato di fare fin dall'inizio è generare un modello da usare per comprendere le interazioni tra i neuroni del MA e il sistema vascolare cerebrale", afferma Kamm. "Dato che ci sono stati così pochi successi nello sviluppo di terapie efficaci contro il MA, negli ultimi due anni si è prestata maggiore attenzione alla CAA".
Il suo laboratorio ha iniziato a lavorare su questo progetto diversi anni fa, insieme ai ricercatori del MGH che avevano progettato i neuroni per produrre grandi quantità di proteine Aβ, proprio come le cellule cerebrali dei pazienti di MA.
Guidati da Shin, i ricercatori hanno escogitato un modo per far crescere queste cellule in un canale microfluidico, dove producono e secernono proteine Aβ. Sullo stesso chip, in un canale parallelo, i ricercatori hanno sviluppato cellule endoteliali cerebrali, che sono le cellule che formano la barriera emato-encefalica. Un canale vuoto separava i due canali mentre si sviluppava ogni tipo di tessuto.
Dopo 10 giorni di crescita cellulare, i ricercatori hanno aggiunto collagene al canale centrale che separa i due tipi di tessuto, il che ha permesso alle molecole di diffondersi da un canale all'altro. Hanno scoperto che entro 3-6 giorni, le proteine Aβ secrete dai neuroni hanno iniziato ad accumularsi nel tessuto endoteliale, il che ha portato le cellule ad avere perdite. Queste cellule hanno anche mostrato un declino delle proteine che formano giunzioni strette e un aumento degli enzimi che scompongono la matrice extracellulare che normalmente circonda e supporta i vasi sanguigni.
Come risultato di questa rottura della barriera emato-encefalica, la trombina è riuscita a passare dal sangue che fluisce attraverso i vasi che perdono nei neuroni del MA. Livelli eccessivi di trombina possono danneggiare i neuroni e portare alla morte cellulare.
"È stato possibile dimostrare questa segnalazione bidirezionale tra i tipi di cellule e solidificare realmente le cose che erano state viste in precedenza in esperimenti su animali, ma di riprodurle in un sistema modello che possiamo controllare con molti più dettagli e una migliore fedeltà", afferma Kamm.
Tappare le perdite
I ricercatori hanno quindi deciso di testare due farmaci che in precedenza avevano dimostrato di solidificare la barriera emato-encefalica in modelli più semplici di tessuto endoteliale. Entrambi questi farmaci sono approvati dalla FDA per il trattamento di altre condizioni. I ricercatori hanno scoperto che uno di questi farmaci, l'etodolac, ha funzionato molto bene, mentre l'altro, beclometasone, ha avuto scarso effetto sulla perdita nel modello di tessuto.
Nei tessuti trattati con etodolac, la barriera emato-encefalica si è rafforzata e sono migliorati i tassi di sopravvivenza dei neuroni. Il team MIT e MGH sta ora lavorando con un consorzio farmaceutico per cercare altri farmaci che potrebbero essere in grado di ripristinare la barriera emato-encefalica nei pazienti con MA.
"Stiamo iniziando a usare questa piattaforma per lo screening di farmaci che sono usciti da selezioni a cellula singola molto semplici, che ora dobbiamo convalidare in un sistema più complesso", afferma Kamm. "Questo approccio potrebbe offrire una nuova forma potenziale di trattamento per il MA, soprattutto se si considera che pochi trattamenti hanno dimostrato di essere efficaci".
Fonte: Anne Trafton in Massachusetts Institute of Technology (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Yoojin Shin, Se Hoon Choi, Eunhee Kim, Enjana Bylykbashi, Jeong Ah Kim, Seok Chung, Doo Yeon Kim, Roger D. Kamm, Rudolph E. Tanzi. Blood–Brain Barrier Dysfunction in a 3D In Vitro Model of Alzheimer's Disease. Advanced Science, 12 Aug 2019, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.















 Associazione Alzheimer OdV
Associazione Alzheimer OdV