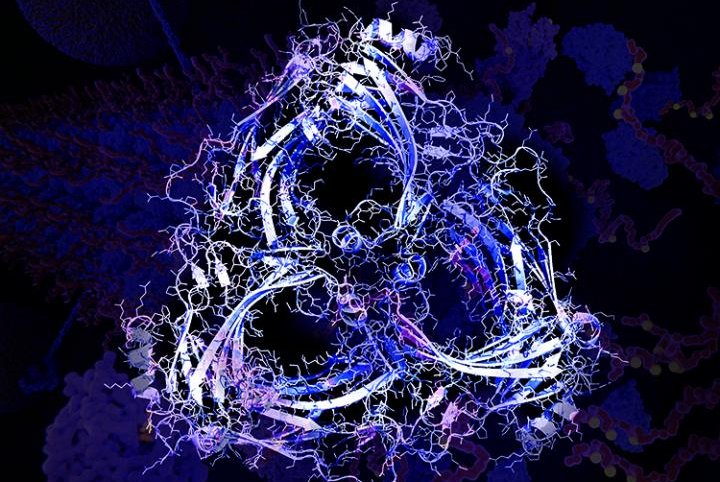
 Un oligomero β-arrestina-2 (in primo piano con il bianco) in un neurone (sfondo). La β-arrestina-2 oligomerizzerata ha un ruolo centrale nel compromettere l'eliminazione della tau e nello sviluppo dei suoi aggregati (magenta) nella demenza frontotemporale e nell'Alzheimer. (Fonte: Cynthia Greco & Eric Lewandowski / USF)
Un oligomero β-arrestina-2 (in primo piano con il bianco) in un neurone (sfondo). La β-arrestina-2 oligomerizzerata ha un ruolo centrale nel compromettere l'eliminazione della tau e nello sviluppo dei suoi aggregati (magenta) nella demenza frontotemporale e nell'Alzheimer. (Fonte: Cynthia Greco & Eric Lewandowski / USF)
La proteina β-arrestina-2 aumenta l'accumulo di grovigli tau neurotossici, una causa di diverse forme di demenza, interferendo con la rimozione dell'eccesso di tau dal cervello, secondo un nuovo studio eseguito alla University of South Florida (USF).
I ricercatori della USF hanno scoperto che una forma della proteina costituita da più molecole di β-arrestina-2, chiamata β-arrestina-2 oligomerizzata, interrompe il processo protettivo di eliminazione che di norma libera le cellule dalle proteine tau malformate patogene. La β-arrestina-2 monomerica, la forma a singola molecola della proteina, non impedisce questo processo di smaltimento dei rifiuti tossici cellulare, chiamato autofagia.
I loro risultati sono stati pubblicati in Proceedings of the National Academy of Sciences (PNAS).
Lo studio si è concentrato sulla degenerazione frontotemporale lobare (FTLD), detta anche demenza frontotemporale, seconda solo al morbo di Alzheimer (MA) per diffusione. Questa demenza aggressiva, in genere ad insorgenza precoce (45-65 anni), è caratterizzata da atrofia delle regioni frontale o laterale del cervello, o di entrambi. Come il MA, la FTLD mostra un accumulo di tau, e non ha alcun trattamento o cura specifica.
"La nostra ricerca potrebbe portare a una nuova strategia per bloccare la patologia tau nella FTLD, nel MA e nelle altre demenze correlate, che alla fine distrugge le capacità cognitive come il ragionamento, il comportamento, il linguaggio e la memoria", ha detto la prima autrice JungA (Alexa) Woo PhD, assistente professore di farmacologia molecolare e di fisiologia, e ricercatrice del Byrd Alzheimer's Center.
"Non abbiamo ancora capito perché il cervello non riesce ad eliminare l'accumulo di tau", ha detto Stephen B. Liggett MD, autore senior e professore di medicina e ingegneria medica dell'USF. "Sembra che ci sia un'«interazione incidentale» tra la β-arrestina-2 e il meccanismo di eliminazione della tau, che porta a queste demenze. La β-arrestina-2 in sé stessa non è dannosa, ma questa interazione imprevista sembra essere la base di questo mistero".
"Questo studio identifica la β-arrestina-2 come un colpevole chiave nell'accumulo progressivo di tau nel cervello dei pazienti con demenza", ha detto il coautore David Kang PhD, professore di medicina molecolare e direttore della ricerca di base del Byrd Alzheimer's Center. "Ed illustra chiaramente anche una innovativa strategia prova-di-concetto per ridurre terapeuticamente la proteina tau, puntando specificatamente l'oligomerizzazione della β-arrestina-2".
Le due caratteristiche principali del MA sono i ciuffi di frammenti appiccicosi della proteina amiloide-beta (Aβ), chiamate placche amiloidi, e i grovigli della proteina tau che soffocano i neuroni. Sono necessari accumuli anormali di entrambe le proteine per guidare la morte dei neuroni nel MA, anche se gli accumuli di tau ora sembrano correlarsi meglio con la disfunzione cognitiva rispetto all'Aβ, e i farmaci che puntano l'Aβ sono stati deludenti come trattamento.
L'aggregazione dell'Aβ è assente nel cervello con FTLD, dove la caratteristica chiave della neurodegenerazione sembra essere l'accumulo eccessivo di tau, chiamato taupatia. I grovigli neurofibrillari risultanti - fibre contorte cariche di tau - distruggono la comunicazione sinaptica tra i neuroni, uccidendo alla fine le cellule del cervello. "Studiare la FTLD ci ha dato quella finestra su una caratteristica fondamentale di entrambi i tipi di demenze, senza la confusione di qualsiasi componente dell'Aβ", ha detto la dott.ssa Woo.
La β-arrestina-2 monomerica è nota primariamente per la sua capacità di regolare i recettori, le molecole sulla cellula che sono responsabili della segnalazione ormonale e dei neurotrasmettitori. La β-arrestina-2 può anche formare più unità di interconnessione, chiamate oligomeri. La funzione degli oligomeri β-arrestina-2 non è ancora ben compresa.
La forma monomerica è stata la base degli studi iniziali del laboratorio per esaminare la tau e il suo rapporto con la neurotrasmissione e i recettori, "ma ben presto si è inchiodata su questi oligomeri della β-arrestina-2", ha detto la dott.ssa Woo. Alcune delle scoperte riferite dai ricercatori in PNAS:
- i livelli di β-arrestina-2 sono più alti sia nelle cellule che nei topi con tau elevata; inoltre, quando la β-arrestina-2 è sovra-espressa, i livelli di tau aumentano, suggerendo un ciclo disadattivo di reazione che aggrava la tau patogena;
- ridurre geneticamente la β-arrestina-2 diminuisce la taupatia, la disfunzione sinaptica, e la perdita di cellule nervose e delle loro connessioni nel cervello; per questo esperimento i ricercatori hanno incrociato un topo modello di taupatia precoce con topi geneticamente modificati in cui il gene β-arrestina-2 era disattivato o eliminato;
- la β-arrestina-2 oligomerizzata - ma non la forma monomerica della proteina - aumenta la tau; i ricercatori hanno impedito alle molecole di β-arrestina-2 di legarsi insieme per creare forme oligeromizzate della proteina; hanno dimostrato che la proteina tau patogena diminuisce significativamente quando è presente soltanto β-arrestina-2 oligomerica, che non si lega ai recettori;
- la β-arrestina-2 oligomerizzata aumenta la tau ostacolando la capacità della proteina di trasporto p62 di aiutare a degradare selettivamente l'eccesso di tau nel cervello; in sostanza, questo riduce l'efficienza del processo di autofagia necessario per eliminare la tau tossica, quindi la tau si "raggruma" nei neuroni;
- il blocco dell'oligomerizzazione della β-arrestina-2 sopprime la tau patogena in un topo modello che sviluppa taupatia umana con segni di demenza.
"Abbiamo anche notato che diminuire la β-arrestina-2 mediante terapia genica non ha effetti collaterali apparenti, ma tale riduzione era sufficiente per aprire a pieno regime il meccanismo di eliminazione della tau, cancellando i grovigli tau come una gomma", ha dichiarato il Dott. Liggett. "Questo è qualcosa che il settore stava cercando, un intervento che non fa male e inverte la malattia".
Gli autori dello studio concludono: "Sulla base dei nostri risultati, gli effetti dell'inibizione dell'oligomerizzazione della β-arrestina-2 ha probabilità non solo di inibire lo sviluppo di nuovi grovigli tau, ma anche di eliminare gli accumuli di tau esistenti per merito del meccanismo di eliminazione della tau".
Il lavoro è coerente con una nuova strategia di trattamento che potrebbe essere preventiva per i soggetti a rischio o con un lieve deterioramento cognitivo, e anche per quelli con demenze evidenti causate dalla tau, diminuendo i grovigli di tau esistenti.
Fonte: University of South Florida (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: β-Arrestin2 oligomers impair the clearance of pathological tau and increase tau aggregates.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV