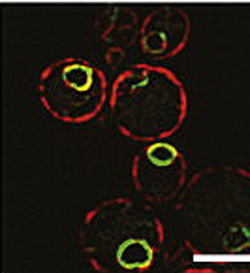
 Immagine fluorescente di cellule di lievito che dimostra che la proteina Ypf1 del lievito (verde), simile alla Presenilina, si trova nella stessa zona cellulare della Presenilina, attorno al nucleo. (Fonte: Weizmann Institute)Perchè una cellula dovrebbe prendersi la briga di distruggere proteine del tutto perfette, appena coniate?
Immagine fluorescente di cellule di lievito che dimostra che la proteina Ypf1 del lievito (verde), simile alla Presenilina, si trova nella stessa zona cellulare della Presenilina, attorno al nucleo. (Fonte: Weizmann Institute)Perchè una cellula dovrebbe prendersi la briga di distruggere proteine del tutto perfette, appena coniate?
Una nuova ricerca condotta all'Istituto Weizmann e in centri di ricerca in Germania, pubblicata recentemente in Molecular Cell, suggerisce che questo meccanismo cellulare insolito può essere difettoso nell'Alzheimer, tra le altre cose.
Il Dr. Maya Schuldiner e lo specializzando di ricerca Dr. Shai Fuchs del Dipartimento di Genetica Molecolare del Weizmann Institute, in collaborazione con il Dr. Marius Lemberg e il Dr. Donem Avci della Heidelberg University, hanno esaminato la Presenilina, una proteina umana che presenta una mutazione nella forma familiare ad insorgenza precoce dell'Alzheimer.
Per studiare il meccanismo di questa proteina, i ricercatori hanno esaminato l'antenato della Presenilina, la proteinaYpf1 (Yeast Presenilin Fold1) del lievito, che è rimasta ben conservata nel corso dell'evoluzione. Quando hanno rimosso la Ypf1 dalle cellule di lievito, il risultato è stato un eccesso di una proteina che nella cellula ha il compito di pompare lo [[zinco]], un metallo essenziale.
La cosa sconcertante è che, anche se ci sono due proteine che pompano lo zinco nella cellula, solo una è stata colpita. Quella aumentata è una pompa «turbo», o ad alta affinità; mentre la seconda, la proteina rimasta inalterata è una pompa più da "giorno lavorativo", a bassa affinità. Come la Presenilina, anche la Ypf1 è una proteasi (una proteina che degrada altre proteine), perciò i ricercatori hanno concluso che la sua funzione nella cellula è eliminare i trasportatori «turbo» dello zinco.
In realtà, si sono resi conto che si trovavano di fronte ad una sorta di sistema a due pompe, che era stato descritto per la prima volta diversi anni fa dal Prof. Naama Barkai del Weizmann Institute. Le pompe nutrienti a bassa affinità possono non essere così efficienti nel portare i nutrienti nella cellula, ma sono molto sensibili ai cambiamenti di tali sostanze nutritive; quando calano i livelli, consentono l'attivazione di un piano di riserva.
I trasportatori ad alta affinità possono entrare in azione per accumulare la sostanza nutritiva in preparazione della carenza futura, ma queste pompe non possono attivare il piano di riserva. In questo scenario, le cellule sane dovrebbero funzionare per la maggior parte del tempo con le pompe ordinarie, consentendo alle pompe turbo di raggiungere le superfici esterne solo nel momento del bisogno.
I ricercatori si sono chiesti come potrebbe influire l'eccesso di pompaggio turbo sulla superficie della cellula sulla sua capacità di prepararsi per la scarsità. In effetti le cellule senza Ypf1 sono state molto lente a sentire la mancanza del nutriente, così sono andate male durante il periodo di carenza di zinco e ci hanno messo più tempo a recuperare. Ed erano colpite anche altre cose, oltre alle pompe dello zinco: la ricerca dimostra che, in assenza di Ypf1, i trasportatori ad alta affinità di molti altri nutrienti sono deregolamentati.
"Produrre continuamente trasportatori ad alta affinità e poi degradarli è un tipo di meccanismo a doppia sicurezza che le cellule hanno sviluppato per garantire che i livelli di nutrienti vitali come lo zinco rimangano il più possibile stabili all'interno della cellula", spiega Fuchs. "Anche se non sappiamo ancora esattamente come nell'uomo il meccanismo è legato all'Alzheimer, ci sono alcune prove interessanti che il trasporto dello zinco in particolare, e il trasporto dei metalli in generale, potrebbe avere un ruolo fondamentale nell'insorgenza e nella progressione della malattia".
"Siamo entusiasti del potenziale che ha questo nuovo indizio di aprire nuove direzioni per capire le cause dell'Alzheimer, in quanto non le abbiamo ancora comprese", dice la Schuldiner.
Fonte: Weizmann Institute of Science (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Dönem Avci, Shai Fuchs, Bianca Schrul, Akio Fukumori, Michal Breker, Idan Frumkin, Chia-yi Chen, Martin L. Biniossek, Elisabeth Kremmer, Oliver Schilling, Harald Steiner, Maya Schuldiner, Marius K. Lemberg. The Yeast ER-Intramembrane Protease Ypf1 Refines Nutrient Sensing by Regulating Transporter Abundance. Molecular Cell, 2014; DOI: 10.1016/j.molcel.2014.10.012
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |

















 Associazione Alzheimer OdV
Associazione Alzheimer OdV