Ricercatori dell'Alzheimer's Disease Research Center della School of Medicine alla Emory University hanno identificato un tipo di patologia finora ignorato nel cervello dei pazienti con Alzheimer.
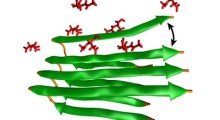
Queste strutture aggrovigliate appaiono nei primi stadi dell'Alzheimer e non si trovano in altre malattie neurodegenerative come il Parkinson. Ciò che rende diversi questi grovigli è che essi sequestrano le proteine coinvolte nello splicing dell'RNA, il processo di taglio e incolla dei messaggi con le istruzioni inviate dai geni.
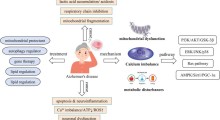
I ricercatori indicano che la comparsa di questi grovigli è legata a cambiamenti diffusi nello splicing dell'RNA nel cervello di Alzheimer, rispetto ai cervelli sani. La scoperta potrebbe cambiare la comprensione dello sviluppo e della progressione della malattia, spiegando il modo in cui i geni legati all'Alzheimer producono effetti, e potrebbe portare a nuovi biomarcatori, approcci diagnostici e terapie.
"Ci ha molto sorpreso trovare alterazioni nelle proteine responsabili dello splicing dell'RNA nell'Alzheimer, fatto che potrebbe avere importanti implicazioni per il meccanismo di malattia", dice Allan Levey, MD, PhD, docente di neurologia alla Emory University School of Medicine e direttore dell'ADRC dell'Emory. "Questa è un'arena nuovissima", dice James Lah, MD, PhD, professore associato di neurologia alla Emory University School of Medicine e direttore del programma di Neurologia Cognitiva. "Molti ricercatori di Alzheimer hanno esaminato il modo in cui la malattia colpisce lo splicing alternativo dei singoli geni. Questi risultati suggeriscono che è in atto una distorsione globale nell'elaborazione dell'RNA".
La ricerca è stata guidata dai Drs. Levey, Lah e Junmin Peng, PhD, che in precedenza era professore associato di genetica alla Emory ed è ora membro di facoltà al Research Hospital del St Jude Children. Essi sono stati aiutati da collaboratori dell'Università del Kentucky, della Rush University e dell'Università di Washington, così come dai colleghi della Emory. I risultati sono pubblicati nei Proceedings of the National Academy of Sciences, Early Edition.
L'accumulo di placche e grovigli nel cervello dei pazienti con Alzheimer é stato osservato più di un secolo fa. Indagare le proteine in queste strutture patologiche è stato centrale per lo studio della malattia. La maggior parte dei trattamenti sperimentali per l'Alzheimer miravano a contenere l'amiloide-beta, un frammento di proteina tossica che a quanto pare è la componente dominante delle placche amiloidi. Altri approcci mirano l'accumulo anomalo della proteina tau in grovigli neurofibrillari.
Eppure lo sviluppo dell'Alzheimer non si può spiegare solo dalle patologie dell'amiloide e della tau, secondo Lah. "Due individui possono ospitare simili quantità di placche amiloidi e grovigli di tau nel cervello, ma uno potrebbe essere completamente sano, mentre l'altro può avere una grave perdita di memoria e demenza", dice. Queste discrepanze hanno portato i ricercatori della Emory a prendere un approccio proteomico "back to basics" [ripartire dai basici], catalogando le proteine che compongono i depositi insolubili nel cervello dei malati di Alzheimer. "Il settore dell'Alzheimer è sempre stato molto concentrato sull'amiloide e la tau, e abbiamo voluto usare le tecnologie di proteomica odierne per adottare un approccio imparziale globale", dice Levey.
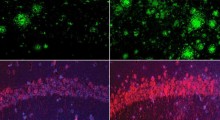
Il team ha identificato 36 proteine che erano molto più abbondanti nei depositi resistenti del tessuto cerebrale dei pazienti di Alzheimer. La lista comprende i soliti noti (tau ed amiloide-beta), ma anche diverse proteine "U1 snRNP" coinvolte nello splicing dell'RNA. Queste proteine U1 sono di solito visibili nel nucleo delle cellule normali, ma nel cervello di Alzheimer si accumulano in strutture aggrovigliate. Si è notato l'accumulo di proteine U1 insolubili nei campioni di pazienti con decadimento cognitivo lieve (MCI), una fase precursore dell'Alzheimer, ma la patologia U1 non si è notata nelle altre malattie del cervello che sono state esaminate.
Secondo Chad Hales, MD, PhD, uno degli autori principali dello studio, "l'aggregazione dell'U1 avviene all'inizio della malattia, e i grovigli U1 possono essere presenti indipendentemente dalla patologia tau. In alcuni casi, si vede l'accumulo di proteine insolubili U1 prima della comparsa della tau insolubile, suggerendo che si tratta di un evento molto precoce".
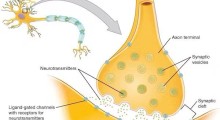
Per la maggior parte dei geni, dopo che l'RNA è letto dal DNA (trascrizione), parte dell'RNA deve essere spliced [modificato]. Quando le cellule del cervello si accumulano in ammassi di proteine U1, ciò potrebbe significare che il processo di splicing è compromesso. Per verificarlo, il team della Emory ha esaminato l'RNA del cervello dei malati di Alzheimer. In confronto all'RNA dei cervelli sani, una parte maggiore dell'RNA dei campioni di cervello di Alzheimer era unspliced [non elaborata].
La scoperta potrebbe spiegare come producono effetti molti dei geni che sono stati collegati all'Alzheimer. Nelle cellule, l'U1 snRNP ha diversi ruoli nell'elaborazione dell'RNA, compreso il processo lo splicing alternativo, per cui un gene può inviare istruzioni a due o più proteine.
"La disfunzione dell'U1 potrebbe produrre cambiamenti nell'elaborazione dell'RNA che interessano molti geni, o cambiamenti specifici che interessano alcuni geni chiave che sono importanti nell'Alzheimer", dice Lah. "Capire l'interruzione di tale processo fondamentale ci darà quasi certamente modo d'identificare nuovi modi per capire l'Alzheimer e nuovi approcci per il trattamento dei pazienti".
Fonte: Emory Health Sciences.
Riferimenti: B. Bai, C. M. Hales, P.-C. Chen, Y. Gozal, E. B. Dammer, J. J. Fritz, X. Wang, Q. Xia, D. M. Duong, C. Street, G. Cantero, D. Cheng, D. R. Jones, Z. Wu, Y. Li, I. Diner, C. J. Heilman, H. D. Rees, H. Wu, L. Lin, K. E. Szulwach, M. Gearing, E. J. Mufson, D. A. Bennett, T. J. Montine, N. T. Seyfried, T. S. Wingo, Y. E. Sun, P. Jin, J. Hanfelt, D. M. Willcock, A. Levey, J. J. Lah, J. Peng. U1 small nuclear ribonucleoprotein complex and RNA splicing alterations in Alzheimer's disease. Proceedings of the National Academy of Sciences, 2013; DOI: 10.1073/pnas.1310249110
Pubblicato in Science Daily (> English version) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |





 Associazione Alzheimer OdV
Associazione Alzheimer OdV