 È emerso che non tutti gli accumuli di proteine tau sono cattivi, e un team di ricercatori dell'Università della Pennsylvania ha sviluppato un metodo per dimostrarlo.
È emerso che non tutti gli accumuli di proteine tau sono cattivi, e un team di ricercatori dell'Università della Pennsylvania ha sviluppato un metodo per dimostrarlo.
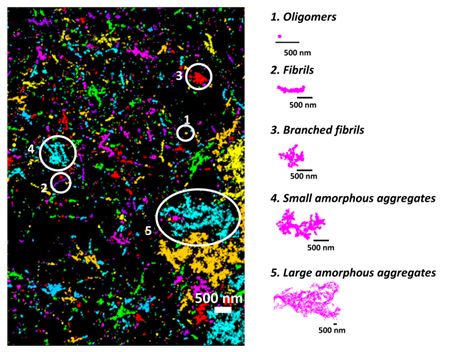
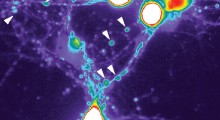
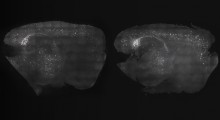
Usando modelli cellulari di mammiferi, i ricercatori hanno combinato la microscopia a risoluzione estremamente alta con l'apprendimento automatico per dimostrare che la tau forma in realtà un piccolo aggregato nell'ambito della fisiologia normale del corpo.
Attraverso questo, sono riusciti a distinguere gli aggregati presenti nelle condizioni sane da quelli associati alle malattie neurologiche, aprendo potenzialmente la porta alla selezione per trattamenti che potrebbero distruggere gli aggregati dannosi. Questa ricerca è stata pubblicata su Proceedings of the National Academy of Sciences.
"Non ci sono molti strumenti che possono visualizzare aggregati proteici piccoli e patologici all'interno delle cellule", ha detto l'autrice senior dello studio, Melike Lakadamyali PhD, professoressa associata di fisiologia. "Ma attraverso l'apprendimento automatico, informato dalla microscopia a super-risoluzione, crediamo di essere riusciti a dimostrare che la tau costituisce sia aggregati fisiologici normali, che distinti aggregati patologici. In tal modo, abbiamo creato un metodo utile che potrebbe essere la base per una nuova ricerca sui trattamenti appropriati per le patologie relative alla tau".
La tau è una proteina attaccata alla struttura dei microtubuli degli assoni, le autostrade per i segnali delle cellule nervose. Finora si pensava che gli aggregati tau si formassero solo dopo che la tau si stacca dai microtubuli. Questi aggregati sono stati associati a alcune malattie neurologiche, compreso l'Alzheimer e altri tipi di demenza. Tuttavia, si scopre che piccoli aggregati di tau possono anche formarsi all'esterno delle condizioni di malattia.
"C'è intrinsecamente valore nell'essere in grado di dire quali aggregati tau fanno parte del sistema nervoso della persona sana e quali formano aggregati dannosi", ha detto la prima autrice dello studio, Melina Theoni Gyypaki, dottoranda nel laboratorio della Lakadamyali. "Sfortunatamente, non c'è stato ancora un processo abbastanza sensibile da fare quella distinzione all'interno delle cellule. Quindi abbiamo deciso di crearne uno usando modelli cellulari dei mammiferi".
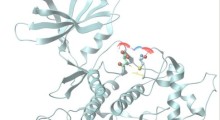
Innanzitutto, i ricercatori hanno usato microscopi a risoluzione estremamente alta, in grado di vedere le singole molecole, per differenziare gli oligomeri fisiologici da quelli patologici (formazioni molecolari). Monomeri, dimeri e trimetri, che sono gli oligomeri costituiti da uno, due e tre molecole di tau, rispettivamente, erano più propensi a finire per essere associati alle condizioni fisiologiche sane perché erano associati ai microtubuli e alle funzionalità regolari.
Quando la squadra ha esaminato le strutture di tau associate a un modello cellulare di mammifero che approssimava la demenza frontotemporale con parkinsonismo collegato al cromosoma 17 (FTDP-17), una malattia associata all'aggregazione della tau, le strutture erano più grandi e più complesse. Questi sembravano aggregati patologici tau che si erano rotti.
Con le differenze assodate nella configurazione, i ricercatori hanno creato un algoritmo di apprendimento automatico per classificare gli aggregati patologici tau solo per la loro forma. Inoltre, hanno usato anticorpi in grado di rilevare e differenziare quando gli aggregati tau diventano 'iper-fosforilati', quando raccolgono molti gruppi di fosfato e tendono a rompersi dannosamente.
La combinazione di questi metodi ha mostrato che la tau contenente gruppi di fosfato su alcuni aminoacidi era più propensa a formare fibrille lineari, una struttura sottile, al contrario di altre forme di aggregati di tau.
"Il metodo che abbiamo sviluppato per identificare gli aggregati di tau non è ancora uno strumento diagnostico, ma pensiamo che sarebbe uno strumento di ricerca utile per chiunque sia interessato a studiare i meccanismi che portano all'oligomerizzazione proteica patologica nella malattia neurodegenerativa", ha detto la Lakadamyali.
Gli aggregati di tau non sono gli unici a cui questo metodo potrebbe essere usato per la loro classificazione. C'è l'opportunità di usarlo su altri accumuli di proteine potenzialmente patologici, come l'alfa-sinucleina, che è associata al Parkinson o l'huntingtina, correlata alla malattia di Huntington. Potrebbe anche essere usato per selezionare potenziali trattamenti per queste condizioni che non danneggiano i complessi proteici regolari del corpo.
Il team sta studiando potenziali meccanismi per eliminare gli aggregati di tau e determinare quali altri percorsi potrebbero essere utili a questo riguardo.
"Stiamo anche usando il metodo che abbiamo ideato per visualizzare gli aggregati di tau nelle fette del tessuto cerebrale postmortem di individui con Alzheimer, e determinare il ruolo dei cambiamenti post-traslazionali della tau nell'aggregazione", ha detto la Lakadamyali.
Fonte: University of Pennsylvania (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Melina Theoni Gyparaki, Arian Arab, Elena Sorokina, Adriana Santiago-Ruiz, Christopher Bohrer, Jie Xiao, Melike Lakadamyali. Tau forms oligomeric complexes on microtubules that are distinct from tau aggregates. PNAS, 11 May 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV