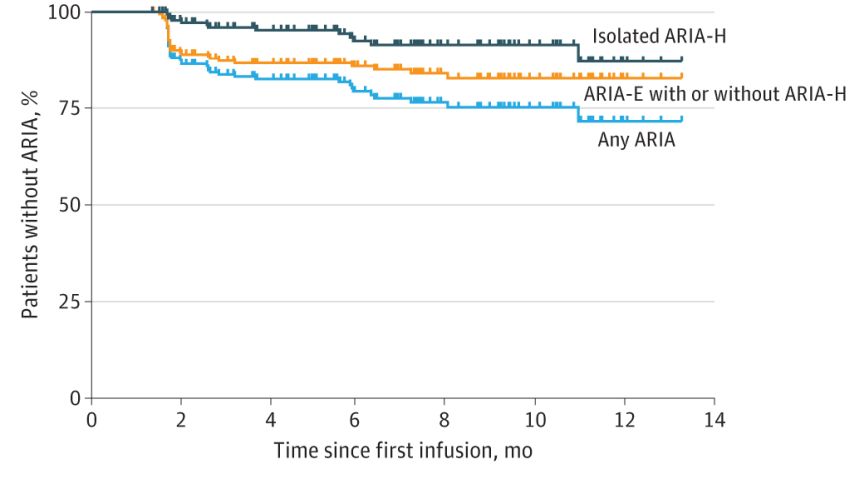
 Casi di ARIA nelle infusioni cliniche di Lecanemab. Fonte: Paczynski et al / WashU / Jama Network
Casi di ARIA nelle infusioni cliniche di Lecanemab. Fonte: Paczynski et al / WashU / Jama Network
La demenza è una condizione che provoca problemi progressivi di memoria o di pensiero. Ora è la causa di morte più comune in Australia. Esistono molte cause diverse di demenza, ma il morbo di Alzheimer (MA) rappresenta circa il 60-80% di tutti i casi. La scorsa settimana, la Therapeutic Goods Administration (TGA) australiana ha approvato un nuovo farmaco per il MA iniziale: il lecanemab, venduto con il marchio Leqembi.
Questo fa seguito all'approvazione di un farmaco simile, il donanemab, all'inizio di quest'anno. Ma, sebbene il lecanemab abbia dimostrato di rallentare la progressione della malattia in alcune persone che hanno ricevuto una diagnosi precoce, ha un cartellino-prezzo elevato che lo mette fuori portata di molti australiani.
Come funziona?
Il lecanemab fa parte di una classe di farmaci chiamati anticorpi monoclonali. Quando il nostro corpo si trova di fronte a 'invasori' dall'esterno, di solito batteri o virus, il sistema immunitario risponde producendo anticorpi. Queste sono proteine che si legano all'invasore e lo marcano perché altre cellule immunitarie lo riconoscano e lo distruggano.
Un anticorpo monoclonale viene prodotto in un laboratorio per legarsi a un bersaglio specifico: in questo caso, la proteina amiloide che è la caratteristica microscopica del MA. Una volta che il sistema immunitario cattura l'anticorpo, può rimuovere l'amiloide dal nostro cervello per limitare i danni in atto.
Quanto è efficace?
L'approvazione locale arriva a seguito di una grande sperimentazione clinica di 1.734 partecipanti per 18 mesi, finanziata dalla società farmaceutica giapponese Eisai. Lo studio ha mostrato un rallentamento significativo della progressione della malattia in un folto gruppo di pazienti che avevano il MA precoce o una lieve compromissione cognitiva dovuta ai primi cambiamenti del MA nel cervello.
Prima dello studio, tutti i pazienti hanno avuto scansioni con tomografia a emissione di positroni (PET) che mostravano la presenza di proteina amiloide nel cervello. Coloro che hanno ricevuto il farmaco attivo durante lo studio si sono aggravati il 27% in meno rispetto a quelli a cui è stato dato il placebo nei 18 mesi. Ciò è stato misurato da una scala sia di cognizione che di funzione, nota come Clinical Dementia Rating Sum of Boxes.
Durante il periodo di studio di 18 mesi, ciò equivale a circa 5 mesi in meno di declino nel gruppo che ha ricevuto il lecanemab. Per i pazienti che hanno continuato il trattamento, è stata presentata di recente l'evidenza di continui benefici per circa 4 anni. I partecipanti che hanno ricevuto lecanemab hanno anche mostrato grandi riduzioni dei livelli di amiloide nel cervello, misurati da una scansione PET. Alla fine dell'esperimento, la maggior parte dei partecipanti era considerata al di sotto della soglia che di norma indicherebbe la presenza di MA, ma i loro sintomi non si sono invertiti.
Quali sono gli effetti collaterali?
I regolatori hanno sollevato preoccupazioni sulla sicurezza. Il TGA aveva in precedenza respinto l'approvazione del farmaco sulla base del suo profilo di rischio-beneficio quando ha originariamente considerato la domanda nell'ottobre dello scorso anno. Circa il 12,6% dei partecipanti alla sperimentazione che ha ricevuto il farmaco ha sperimentato gonfiore del cervello. I tassi sono saliti al 32,6% nei portatori di 2 copie di un gene che promuove il MA, l'apolipoproteina E4 (APOE4).
Di coloro che hanno avuto gonfiore nel cervello, il 22% ha avuto effetti collaterali come mal di testa, vertigini, visione offuscata e problemi di equilibrio. Questi erano generalmente lievi, ma un piccolo numero di partecipanti che prendevano anche farmaci anticoagulanti durante lo studio hanno avuto sanguinamenti cerebrali gravi che hanno provocato la morte. Il restante 78% di coloro che hanno sviluppato gonfiore cerebrale non ha avuto sintomi da esso.
A causa del rischio di gonfiore del cervello, coloro che assumono il farmaco richiedono scansioni MRI trimestrali per monitorare il loro cervello. Circa il 17,3% di quelli nel farmaco attivo ha anche sperimentato piccoli sanguinamenti nel cervello (microemorragie), rispetto al 9,0% di quelli che assumevano un placebo. Il rifiuto della TGA di approvare il lecanemab l'anno scorso è stato appellato e sono stati presentati nuovi dati sulla sicurezza e sui risultati a 4 anni di trattamento come parte del ricorso.
Quanto costa?
Il Pharmaceutical Benefit Scheme (PBS) dell'Australia, che sovvenziona i farmaci prescritti, non interviene al momento per il lecanemab, che costa l'equivalente di A$ 40.000 all'anno (circa 22.500 Euro), mettendolo oltre la portata di molti che potrebbero trarne beneficio. Le linee guida raccomandano il dosaggio a intervalli quindicinali per un periodo di 18 mesi, con un dosaggio mensile di 'manutenzione' in seguito. Ci sono anche costi associati al monitoraggio richiesto per garantire la sicurezza e l'efficacia del farmaco (visite dei medici, risonanza magnetica e scansioni PET).
Il Pharmaceutical Benefits Advisory Committee (PBAC) non ha ancora considerato il lecanemab per il rimborso di PBS. Tuttavia, a luglio il PBAC ha respinto una domanda per un farmaco simile, il donanemab, per l'inserimento nel PBS, in base alla preoccupazione che i benefici erano "troppo piccoli e incerti per giustificare l'onere di questo trattamento sia sui pazienti che sul sistema sanitario". Il lecanemab lavora in modo simile al donanemab, che ha ricevuto l'approvazione TGA all'inizio di quest'anno. Entrambi i farmaci hanno costi, efficacia e rischi simili.
In conclusione
Il lecanemab può essere usato solo nelle prime fasi di MA. Se tu o una persona cara hai i primi segni del MA, come una perdita continua di memoria a breve termine o confusione su giorni e date, è importante chiedere presto consulenza medica, ottenere una diagnosi accurata e chiarire le opzioni terapeutiche.
Se stai prendendo in considerazione lecanemab o donanemab, è importante sapere che questi farmaci non sono cure per il MA. Possono rallentare la progressione, ma non migliorano i sintomi. Il lecanemab non darà vantaggi a quelli la cui demenza è causata da condizioni diverse dal MA, né a quelli con MA nelle fasi oltre la prima.
Fonte: Steve Macfarlane, capo dei servizi clinici di Dementia Support Australia e professore associato di psichiatria alla Monash University
Pubblicato su The Conversation (> English) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV