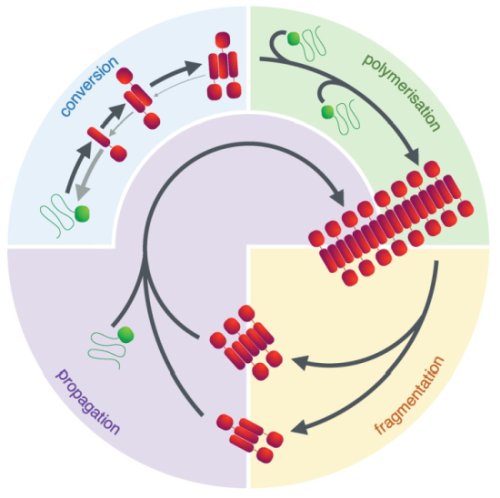
 Il ciclo di vita del prione. La formazione ex-novo di un prione comporta la trasformazione anomala di proteine e la conseguente formazione di conforme amiloidi, che possono essere assemblate in piccole specie oligomeriche. Una volta che questo complesso raggiunge una dimensione critica (cioè la dimensione del nucleo), è favorita un'ulteriore polimerizzazione e crescono le fibrille con l'aggiunta di monomeri proteici alle loro estremità. Questo processo può essere accelerato dalla frammentazione delle fibrille, che aumenta il numero delle loro estremità a cui si aggiunge il monomero. Nel lievito Saccharomyces cerevisiae questo è fatto dal chaperone molecolare Hsp104 e dai relativi co-chaperoni ed è essenziale per ottenere un numero idoneo di particelle prioniche (propagoni) di dimensione appropriata che garantisce la loro trasmissione (propagazione) durante la divisione cellulare. (Fonte: Merchante et al.)La scoperta di un team di scienziati, guidati dal Dott. Wei-Feng Xue dell'Università del Kent, potrebbe condurre a capire meglio alcune malattie e suggerire potenziali strategie diagnostiche e terapeutiche per combattere la progressione delle malattie associate all'amiloide (come l'Alzheimer) e la loro possibile infettività.
Il ciclo di vita del prione. La formazione ex-novo di un prione comporta la trasformazione anomala di proteine e la conseguente formazione di conforme amiloidi, che possono essere assemblate in piccole specie oligomeriche. Una volta che questo complesso raggiunge una dimensione critica (cioè la dimensione del nucleo), è favorita un'ulteriore polimerizzazione e crescono le fibrille con l'aggiunta di monomeri proteici alle loro estremità. Questo processo può essere accelerato dalla frammentazione delle fibrille, che aumenta il numero delle loro estremità a cui si aggiunge il monomero. Nel lievito Saccharomyces cerevisiae questo è fatto dal chaperone molecolare Hsp104 e dai relativi co-chaperoni ed è essenziale per ottenere un numero idoneo di particelle prioniche (propagoni) di dimensione appropriata che garantisce la loro trasmissione (propagazione) durante la divisione cellulare. (Fonte: Merchante et al.)La scoperta di un team di scienziati, guidati dal Dott. Wei-Feng Xue dell'Università del Kent, potrebbe condurre a capire meglio alcune malattie e suggerire potenziali strategie diagnostiche e terapeutiche per combattere la progressione delle malattie associate all'amiloide (come l'Alzheimer) e la loro possibile infettività.
Attualmente c'è un carenza di conoscenza dei fattori che governano il potenziale infettivo dell'amiloide in generale, un gap in parte coperto da un articolo pubblicato nella rivista eLife dal team del dottor Xue.
In esso si riferiscono le indagini sul motivo per cui alcune forme di amiloide sono altamente infettive (la cosiddetta forma prionica associata alla malattia della mucca pazza e la sua forma umana Creutzfeldt Jakob) mentre altre sono meno infettive o addirittura inerti.
I ricercatori hanno scoperto che il potenziale infettivo di un'amiloide è una proprietà biologica complessa, che si può descrivere meglio su una scala scorrevole piuttosto che su una categoria (prioni trasmissibili) o un'altra (amiloide non trasmissibile), come è ora.
Attualmente, la maggior parte delle amiloidi, tranne i prioni, sono considerate non trasmissibili tra gli individui, implicando che le persone non potrebbero 'prendere' l'Alzheimer o il Parkinson semplicemente per contagio.
Questa ricerca fa nuova luce sul perché alcune forme di amiloide possono potenzialmente diffondersi tra cellule e tessuti all'interno dello stesso individuo e alcune sono considerate di tipo prionico, trasmissibili da un individuo all'altro.
Fonte: Sandy Fleming in University of Kent (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Ricardo Marchante, David M. Beal, Nadejda Koloteva-Levine, Tracey J. Purton, Mick F. Tuite and Wei-Feng Xue. The physical dimensions of amyloid aggregates control their infective potential as prion particles. eLIFE, 7 Sept 2017. doi: 10.7554/eLife.27109
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali colelgamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV