Anche se si potrebbe pensare che il cervello delle persone che sviluppano l'Alzheimer (AD) abbiano elementi costitutivi della malattia assenti nel cervello di quelle sane, per la maggior parte dei malati questo non è vero.
Ogni cervello umano contiene gli ingredienti necessari per innescare l'AD, ma mentre circa 5 milioni di americani ne sono colpiti (un numero destinato a triplicarsi entro il 2050) la stragrande maggioranza delle persone non lo è e non svilupperà in futuro la condizione neurologica devastante.
Per ricercatori come Subhojit Roy, MD, PhD, professore associato del Dipartimento di Patologia e Neuroscienze della School of Medicine dell'Università della California di San Diego, questi fatti generano una domanda singolare: perché non siamo tutti colpiti dall'Alzheimer?
In un articolo pubblicato nel numero del 7 Agosto della rivista Neuron, Roy e colleghi offrono una spiegazione: per un trucco della natura che, nella maggior parte delle persone, mantiene la separazione fondamentale tra una proteina e un enzima che, se combinati, attivano la degenerazione progressiva e la morte cellulare caratteristica dell'AD.
"E' come separare fisicamente polvere da sparo e fiammiferi così da evitare l'inevitabile esplosione", ha detto il ricercatore principale Roy, biologo cellulare e neuropatologo del Shiley-Marcos Alzheimer's Disease Research Center dell'UC San Diego. "Sapere come vengono separati la polvere da sparo e i fiammiferi può darci nuove informazioni per riuscire a fermare la malattia".
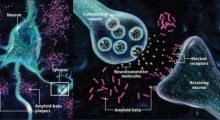
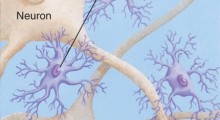
La gravità dell'AD è misurata dalla perdita di neuroni funzionanti. In termini patologici, ci sono due segni rivelatori dell'AD: grumi di una proteina chiamate "placche" di amiloide-beta che si accumulano fuori dei neuroni e filamenti o "grovigli" di un'altra proteina, chiamata tau, che si trova dentro i neuroni. La maggior parte dei neuroscienziati ritengono che l'AD sia causato dall'assemblaggio di accumuli di proteina amiloide-beta che innescano una sequenza di eventi che porta alla compromissione della funzione delle cellule e alla loro morte. Questa cosiddetta "ipotesi cascata amiloide" mette la proteina amiloide-beta al centro della patologia di AD.
La creazione di amiloide-beta richiede la convergenza di una proteina chiamata proteina precursore dell'amiloide (APP) con un enzima che scinde l'APP in piccoli frammenti tossici, chiamato beta-secretasi o BACE. "Entrambe queste proteine sono molto espresse nel cervello", ha detto Roy, "e se fosse loro permesso di combinarsi continuamente, avremmo tutti l'AD". Ma questo non accade.
Usando colture di neuroni ippocampali e tessuti cerebrali sia umani che di topo, Roy, il primo autore Utpal Das, borsista postdottorato del laboratorio di Roy, e i colleghi, hanno scoperto che le cellule cerebrali sane tengono ben segregati APP e BACE-1 in scomparti distinti, appena sono prodotti, assicurandosi che le due proteine non vengano in contatto. "La natura sembra aver escogitato un trucco interessante per separare i co-cospiratori", ha detto Roy.
Gli scienziati hanno anche scoperto che le condizioni che promuovono una maggiore produzione della proteina amiloide-beta aumentano la convergenza tra APP e BACE. Specificamente, un aumento dell'attività elettrica neuronale (nota per aumentare la produzione di amiloide-beta) porta anche ad un aumento della convergenza APP-BACE. Gli esami post mortem di pazienti di AD hanno rivelato pure una maggiore vicinanza fisica delle proteine, riconfermando il significato fisiopatologico di questo fenomeno nella malattia umana.
Das ha detto che i risultati sono di fondamentale importanza in quanto chiariscono alcuni dei primi eventi molecolari scatenanti l'AD e mostrano come un cervello sano sappia come evitarli in modo naturale. In termini clinici, essi indicano una possibile nuova strada per curare definitivamente, o anche prevenire, la malattia.
"Un aspetto interessante è che possiamo forse cercare le molecole che tengono separate fisicamente APP e BACE-1", ha detto Das. "E' un approccio in qualche modo non convenzionale".
Fonte:University of California, San Diego Health Sciences.
Riferimento: Utpal Das, David A. Scott, Archan Ganguly, Edward H. Koo, Yong Tang, Subhojit Roy. Activity-Induced Convergence of APP and BACE-1 in Acidic Microdomains via an Endocytosis-Dependent Pathway. Neuron, 2013; 79 (3): 447 DOI: 10.1016/j.neuron.2013.05.035
Pubblicato in Science Daily (> English version) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV