Con sofisticate tecniche di imaging degli scienziati hanno osservato un processo di piegatura molecolare delle proteine che può aiutare i ricercatori medici a capire e curare malattie come l'Alzheimer, la Lou Gehrig (SLA) e il cancro.
Lo studio, apparso nel numero di Giugno della rivista Cell, verifica un processo di cui gli scienziati conoscevano l'esistenza, ma con un meccanismo che non erano mai stati in grado di osservare, secondo il dottor Hays Rye, biochimico della Texas A&M AgriLife Research.
"Questo passo va nella direzione di farci capire come modulare i sistemi per prevenire malattie come l'Alzheimer. Avevamo bisogno di capire i macchinari di piegatura della cellula e come interagiscono tra loro in una rete complessa", ha detto Rye, professore associato di biochimica e biofisica alla Texas A&M. Egli spiega che, quando una proteina è prodotta nella cellula, singoli aminoacidi sono collegati tra loro come perle di una collana. "Ma quella sequenza lineare di amminoacidi non è funzionale", precisa. "E' come una struttura di origami che deve ripiegarsi in una forma tridimensionale per svolgere il suo compito".
Rye dice che i ricercatori stanno cercando di capire questo processo da più di 50 anni, ma in una cellula vivente il processo è complicato dalla presenza di molte proteine in un ambiente concentrato. "I vincoli per indurre la proteina a ripiegarsi in una buona struttura a 'origami' sono molto più strigenti" spiega. "Quindi ci sono macchine proteiche speciali nella cella, conosciute come chaperoni [=ciceroni] molecolari, che aiutano le proteine a piegarsi". Ma la domanda che assillava i ricercatori era: come fanno i chaperoni molecolari ad aiutare le proteine a piegarsi quando non riescono a farlo bene da sole? "I chaperoni molecolari sono come piccole macchine, hanno leve e ingranaggi e fonti di energia. Passano attraverso un ribaltamento dei cicli e una sorta di mormorio all'interno della cellula, guidando la reazione di piegatura delle proteine ogni pochi secondi", scrive Rye.
Le numerose reazioni chimiche essenziali per la vita si basano sull'esatta forma tridimensionale delle proteine ripiegate, dice. Nella cellula, gli enzimi per esempio, sono proteine specializzate che aiutano a velocizzare i processi biologici legando le molecole e riunendole nel modo giusto. "Sono legate insieme come un puzzle a tre dimensioni", spiega Rye. "E le proteine - quelle piccole perle della stringa progettate per piegarsi come un origami - sono piegate per posizionare tutte queste perle in uno spazio a tre dimensioni, avvolte perfettamente intorno a quelle molecole e fare quelle reazioni chimiche. Se questo non accade - se la proteina non viene ripiegata bene - la reazione chimica non può accadere e, se è essenziale, la cellula muore perché non può convertire il cibo in energia necessaria per costruire le altre strutture richieste della cellula. Le reazioni chimiche sono il sostegno strutturale che tiene insieme le cellule, e tutto questo dipende dalle proteine piegate nel modo giusto".
Quando una proteina non si piega o si piega in modo errato, si trasforma in un "aggregato", che Rye descrive come "sostanza appiccicosa bianca che assomiglia alla maionese, come un deposito nella provetta". "Sei finito, la cellula muore". Negli ultimi 20 anni, continua, i ricercatori hanno collegato tale processo di aggregazione "abbastanza convincentemente" allo sviluppo di malattie: Alzheimer, Lou Gehrig, Huntington, solo per citarne alcune. Ci sono prove che anche il diabete e il cancro sono legate a disturbi nel ripiegamento delle proteine. "Uno dei principali ruoli dei chaperoni molecolari è prevenire quegli eventi di misfolding [=errata piegatura] di proteine che portano all'aggregazione, e non permettere che una cella sia avvelenata da proteine mal ripiegate o aggregate", ha detto.
Il gruppo di Rye si è concentrato su un chaperone molecolare cruciale: l'HSP60. "Si chiama HSP da 'Heat Shock Protein' [proteina da shock termico] perché quando la cellula è stressata con il calore, le proteine diventano instabili e iniziano a spezzarsi e a dispiegarsi", dice Rye. "La cellula è costruita per rispondere producendo più chaperoni e cercare di risolvere il problema. Questo particolare chaperone prende le proteine non/mal piegate e con una reazione chimica le lega, mettendole letteralmente dentro una piccola 'scatola' ", spiega Rye.
Egli aggiunge che il mistero era come funzionava la piegatura, perché, anche se i ricercatori avevano la prova che questo accadeva, nessuno aveva mai visto esattamente come. Rye e il team si sono concentrati su un mutante modificato chimicamente, che in altri esperimenti era sembrato stallare in un punto importante nel processo che la "macchina" deve seguire per avviare l'azione di piegatura. Questo ha indicato ai ricercatori che lo stallo potrebbe facilitare l'osservazione. Hanno quindi utilizzato la microscopia crio-elettronica per catturare centinaia di migliaia di immagini del processo, a risoluzioni molto elevate, che hanno permesso loro di ricostruire un modello tridimensionale da immagini piane bidimensionali. Un algoritmo informatico molto sofisticato allinea le immagini e le classifica in sottocategorie. "Se ce ne sono abbastanza si può effettivamente ricostruire e visualizzare una struttura come un modello tridimensionale", dice Rye.
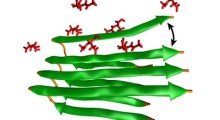
Quello che il team ha visto è: il chaperone HSP60 è progettato per distinguere le proteine non piegate da quelle che lo sono. Le lega e poi un con-chaperone diverso mette un "tappo" sulla parte superiore della scatola mantenendo quelle semi-piegate nella scatola. Hanno visto la scatola muoversi, e parti della molecola si spostano per allontanare dalle proteine legate nella scatola chaperone - il "regalo" che c'è dentro. Ma la proteina legata è mantenuta all'interno del pacchetto dove potrà poi iniziare la reazione di piegatura. Hanno visto minuscoli tentacoli, "come un piccolo polipo sul fondo della scatola che sale e afferra il substrato di proteina e aiuta a tenerlo all'interno della cavità".
"La prima cosa che abbiamo visto è stata una grande quantità di una proteina non piegata all'interno di questa cavità", dice. "Anche se sapevamo da molti altri studi che doveva andare lì, nessuno l'aveva mai vista così prima. Possiamo anche vedere la proteina non nativa interagire con le parti della scatola che nessuno aveva mai visto prima. Era emozionante vedere tutto questo per la prima volta. Penso che abbiamo avuto la visone di una proteina nel processo di folding, che noi effettivamente possiamo paragonare ad altre strutture".
"Capendo il meccanismo di queste macchine, speriamo di imparare ad accenderle e spegnerle quando abbiamo bisogno, come nel caso di pazienti con una delle malattie da piegatura proteica", conclude.
Rye ha collaborato a questa ricerca con Dong-Hua Chen e Wah Chiu del Baylor College of Medicine di Houston, Damian Madan e Zohn Lin alla Princeton University, Jeremy Weaver della Texas A&M e Gunnar Schröder dell'Istituto dei Sistemi Complessi in Germania.
Fonte:Texas A&M AgriLife Communications. Articolo originale scritto da Kathleen Phillips.
Riferimento: Dong-Hua Chen, Damian Madan, Jeremy Weaver, Zong Lin, Gunnar F. Schröder, Wah Chiu, Hays S. Rye. Visualizing GroEL/ES in the Act of Encapsulating a Folding Protein. Cell, 2013; 153 (6): 1354 DOI: 10.1016/j.cell.2013.04.052
Pubblicato in Science Daily (> English version) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV