Una ricerca innovativa ha identificato un ruolo inaspettato dell’enzima deubiquitinasi nella regolazione dell’accumulo di proteina tau tossica.
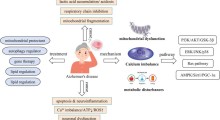
 Il modello di lavoro mostra le funzioni note e nuove della OTULIN che regola proteostasi, morte cellulare, infiammazione e sopravvivenza/sviluppo cellulare. La nuova funzione non canonica identificata in questo studio dimostra il ruolo di OTULIN come regolatore del metabolismo/stabilità dell'RNA e dell'espressione di geni, compresa la tau. Fonte: Kiran Bhaskar / UniNewMexico
Il modello di lavoro mostra le funzioni note e nuove della OTULIN che regola proteostasi, morte cellulare, infiammazione e sopravvivenza/sviluppo cellulare. La nuova funzione non canonica identificata in questo studio dimostra il ruolo di OTULIN come regolatore del metabolismo/stabilità dell'RNA e dell'espressione di geni, compresa la tau. Fonte: Kiran Bhaskar / UniNewMexico
|
Scientists have uncovered a surprising mechanism by which a brain enzyme called OTULIN controls the expression of tau, the protein that forms toxic tangles in Alzheimer's disease. The findings, published today in Genomic Psychiatry, reveal that OTULIN functions not only as expected in protein degradation pathways but also plays a previously unknown role as a master regulator of gene expression and RNA metabolism. The research team, led by Dr. Kiran Bhaskar at the University of New Mexico Health Sciences Center and Dr. Francesca-Fang Liao at the University of Tennessee Health Science Center, made the discovery while investigating how neurons clear abnormal tau aggregates. Their unexpected findings could open new therapeutic avenues for Alzheimer's disease and related dementias affecting millions worldwide. "We set out to test whether stabilizing a specific type of ubiquitin chain would help clear toxic tau from neurons," explained Dr. Karthikeyan Tangavelou, the paper’s first author. "Instead, we discovered something completely unexpected – that OTULIN acts as a master switch controlling whether tau is even produced in the first place.” The Revolutionary DiscoveryThe research team initially hypothesized that inhibiting OTULIN's enzyme activity would enhance tau clearance through cellular garbage disposal systems. However, when they completely knocked out the OTULIN gene in neurons, tau disappeared entirely – not because it was being degraded faster, but because it wasn't being made at all. "This was a paradigm shift in our thinking," said Dr. Liao. "We found that OTULIN deficiency causes tau mRNA to vanish, along with massive changes in how the cell processes RNA and controls gene expression." The study used neurons derived from a patient with late-onset sporadic Alzheimer's disease, which showed elevated levels of both OTULIN protein and phosphorylated tau compared to healthy control neurons. This correlation suggested OTULIN might be contributing to disease progression. Key FindingsThe research revealed several crucial insights: First, when OTULIN was completely removed from neuroblastoma cells, comprehensive RNA sequencing showed dramatic changes in gene expression – 13,341 genes were downregulated and 774 were upregulated, with even more dramatic effects on RNA transcripts (43,003 downregulated, 1,113 upregulated). Comparing Alzheimer's patient neurons to healthy controls revealed over 4,500 genes and 5,600 transcripts were differentially expressed. Second, pharmacological inhibition of OTULIN's enzymatic activity with a novel small molecule inhibitor (UC495) reduced phosphorylated tau levels in Alzheimer's disease neurons, suggesting potential therapeutic benefit without complete gene elimination. Third, the absence of OTULIN upregulated numerous genes associated with RNA degradation and stability regulation, including components of the CCR4-NOT complex and various RNA-binding proteins implicated in neurodegenerative diseases. Fourth, bulk RNA sequencing of Alzheimer's neurons revealed significant downregulation of OTULIN long noncoding RNA alongside decreased expression of melanoma antigen gene (MAGE) family members, which activate ubiquitin ligases involved in protein quality control. Clinical ImplicationsThese findings have profound implications for treating tauopathies, a group of more than 20 neurodegenerative diseases characterized by toxic tau accumulation. "OTULIN could serve as a novel drug target, but our findings suggest we need to modulate its activity carefully rather than eliminate it completely," Dr. Bhaskar noted. "Complete loss causes widespread changes in cellular RNA metabolism that could have unintended consequences." The research demonstrated that partial inhibition with UC495 reduced pathological tau forms without eliminating total tau or causing apparent toxicity to neurons. This suggests a therapeutic window exists where OTULIN activity could be tuned to beneficial levels. The team also discovered that OTULIN deficiency prevents the development of autoinflammation in neurons by downregulating inflammatory pathway components, providing additional insight into how cells balance protein quality control with inflammatory responses. Broader Impact on RNA BiologyBeyond Alzheimer's disease, the findings illuminate fundamental mechanisms of RNA metabolism regulation in neurons. The researchers identified upregulation of transcriptional repressors like YY1 and SP3 in OTULIN-deficient cells, along with changes in RNA-binding ubiquitin ligases RC3H2 and MEX3C that control mRNA stability. "We're essentially looking at a previously unknown checkpoint in gene expression," explained Dr. Liao. "OTULIN appears to influence which genes get expressed and how long their RNA messages survive in cells." The study also revealed connections between OTULIN and multiple neurodegenerative disease-associated RNA-binding proteins, including TDP-43, FMR1, ATXN2, and MSI1, suggesting broader implications for understanding various brain disorders. Research MethodologyThe team used cutting-edge techniques including CRISPR-Cas9 gene editing, induced pluripotent stem cell-derived neurons from Alzheimer's patients and healthy controls, comprehensive bulk RNA sequencing, and computational drug design to identify the OTULIN inhibitor UC495. They validated their findings across multiple cell types, including patient-derived neurons and human neuroblastoma cells, ensuring reproducibility and relevance to human disease. Next StepsThe researchers are now working to understand precisely how OTULIN influences gene expression and RNA metabolism at the molecular level. They're also testing whether carefully calibrated OTULIN inhibition can reduce tau pathology in animal models of Alzheimer's disease. "This discovery opens up an entirely new research direction," said Dr. Bhaskar. "We need to determine whether targeting OTULIN therapeutically can safely reduce tau accumulation without disrupting essential cellular functions." The team is also investigating why OTULIN long noncoding RNA is reduced in Alzheimer's neurons and whether restoring its levels could normalize OTULIN protein expression and tau pathology. |
Degli scienziati hanno scoperto un meccanismo sorprendente mediante il quale un enzima cerebrale chiamato OTULIN controlla l'espressione della tau, la proteina che forma grovigli tossici nel morbo di Alzheimer (MA). I risultati, pubblicati su Genomic Psychiatry, rivelano che OTULIN funziona non solo come previsto nei percorsi di degradazione delle proteine, ma ha anche un ruolo finora sconosciuto come regolatore principale dell’espressione genica e del metabolismo dell’RNA.
La scoperta rivoluzionariaIl gruppo di ricerca inizialmente aveva ipotizzato che l'inibizione dell'attività enzimatica di OTULIN avrebbe migliorato l'eliminazione della tau attraverso i sistemi di smaltimento dei rifiuti cellulari. Tuttavia, quando hanno eliminato completamente il gene OTULIN nei neuroni, la tau è scomparsa del tutto, non perché venisse degradata più velocemente, ma perché non veniva affatto prodotta.
Risultati chiaveLa ricerca ha rivelato diverse informazioni cruciali:
Implicazioni clinicheQuesti risultati hanno profonde implicazioni per il trattamento delle tauopatie, un gruppo di oltre 20 malattie neurodegenerative caratterizzate dall’accumulo di tau tossico. "OTULIN potrebbe essere un nuovo bersaglio farmacologico, ma i nostri risultati suggeriscono che dobbiamo modulare attentamente la sua attività piuttosto che eliminarla completamente", ha osservato il dott. Bhaskar. "La perdita completa provoca cambiamenti diffusi nel metabolismo dell'RNA cellulare che potrebbero avere conseguenze indesiderate".
Impatto più ampio sulla biologia dell’RNAOltre al MA, i risultati illuminano i meccanismi fondamentali della regolazione del metabolismo dell'RNA nei neuroni. I ricercatori hanno identificato una sovraregolazione dei repressori trascrizionali come YY1 e SP3 nelle cellule carenti di OTULIN, insieme a cambiamenti nelle ligasi ubiquitina RC3H2 e MEX3C che legano l'RNA e controllano la stabilità dell'mRNA. "Stiamo essenzialmente osservando un punto di controllo precedentemente sconosciuto nell'espressione genetica", ha spiegato la dott.ssa Liao. "OTULIN sembra influenzare quali geni vengono espressi e quanto tempo sopravvivono nelle cellule i loro messaggi RNA".
Metodologia di ricercaIl team ha impiegato tecniche all'avanguardia tra cui l'editing genetico CRISPR-Cas9, l'induzione di neuroni pluripotenti derivati da cellule staminali di pazienti con MA e controlli sani, il sequenziamento completo dell'RNA in massa e la progettazione computazionale di farmaci per identificare UC495, l'inibitore OTULIN. Hanno convalidato le loro scoperte su più tipi di cellule, compresi i neuroni derivati dai pazienti e le cellule di neuroblastoma umano, garantendo riproducibilità e rilevanza per le malattie umane.
Prossimi passiI ricercatori stanno ora lavorando per capire esattamente come OTULIN influenza l’espressione genetica e il metabolismo dell’RNA a livello molecolare. Stanno anche testando se l'inibizione attentamente calibrata di OTULIN può ridurre la patologia tau in modelli animali di MA. "Questa scoperta apre una direzione di ricerca completamente nuova", ha affermato il dottor Bhaskar. "Dobbiamo determinare se puntare OTULIN a livello terapeutico può ridurre in modo sicuro l'accumulo di tau senza interrompere le funzioni cellulari essenziali".
|
Fonte: Genomic Press via EurekAlert! (> English) - Traduzione di Franco Pellizzari.
Riferimenti: K Tangavelou, [+4], K Bhaskar. The deubiquitinase OTULIN regulates tau expression and RNA metabolism in neurons. Gen Psych, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV