Un nuovo studio mostra che il modo in cui le proteine amiloidi si assemblano in fibrille può essere significativamente influenzato dall'orientamento di rotazione degli elettroni su superfici magnetizzate. A seconda della direzione della magnetizzazione e della chiralità dei componenti delle proteine, i ricercatori hanno osservato importanti differenze nel numero, nella lunghezza e nella struttura delle fibrille risultanti.
 Kapon et al / ACSNano
Kapon et al / ACSNano
Lo studio ha scoperto che l'orientamento magnetico di una superficie può influire significativamente sul modo in cui alcune proteine, in particolare quelle associate al morbo di Alzheimer (MA), si assemblano in strutture più grandi. I risultati suggeriscono che una proprietà fisica nota come 'rotazione elettronica' (electron spin) può influenzare l'autoassemblaggio biologico, con potenziali implicazioni per capire ed eventualmente intervenire nelle condizioni neurodegenerative.
Lo studio è stato pubblicato su ACS Nano e guidato da Yael Kapon, dottorando dell'Istituto Fisica Applicata dell'Università Ebraica di Gerusalemme, sotto la guida del Prof. Yossi Paltiel e in collaborazione con il Prof. Ehud Gazit dell'Università di Tel Aviv.
Campi magnetici e fibrille amiloidi
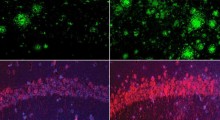
Il centro della ricerca è l'amiloide-beta (Aβ₁-₄₂), un peptide corto noto per formare fibrille e placche appiccicose nel cervello delle persone con MA. Usando superfici magnetizzate, il team ha studiato come questi peptidi si aggregano e se l'orientamento di spin del substrato - essenzialmente, la direzione in cui gli elettroni sono allineati - potrebbe influenzare il processo.
I risultati sono stati sorprendenti. Quando la magnetizzazione della superficie è stata allineata in una direzione, le proteine amiloidi hanno formato quasi il doppio delle fibrille, alcune fino a 20 volte più lunghe, rispetto a quando la magnetizzazione è stata invertita. Il modello si è capovolto anche quando i ricercatori hanno usato una versione del peptide con chiralità opposta (o 'lateralità' molecolare), indicando un forte effetto dipendente da spin.
Questi comportamenti sono coerenti con un fenomeno noto come 'selettività di spin indotta da chirale' (CISS, Chiral-Induced Spin Selectivity), in cui le molecole chirali (asimmetriche) interagiscono in modo diverso con gli elettroni a seconda della loro rotazione. Sebbene questo effetto sia stato studiato in chimica e scienze dei materiali, solo recentemente ha iniziato a essere esplorato nei sistemi biologici.
Comprendere il ruolo dello spin in biologia
Gli autori dello studio ritengono che l'interazione tra chiralità molecolare e spin di elettroni possa avere un ruolo finora sottovalutato nell'autoassemblaggio delle proteine. Usando tecniche come la microscopia elettronica e la spettroscopia a infrarossi, hanno anche scoperto che le strutture amiloidi risultanti variavano non solo per dimensioni e quantità, ma nella loro disposizione molecolare sottostante, a seconda della direzione della magnetizzazione.
"Stiamo cominciando a vedere che la biologia potrebbe essere più sensibile allo spin di quanto si pensava", ha affermato il Prof. Yossi Paltiel dell'Università Ebraica. "Il nostro lavoro mostra che le forze correlate allo spin possono influenzare direttamente il modo in cui le proteine si aggregano. Questa è una nuova dimensione da considerare quando si pensa a malattie come il MA, che coinvolgono l'accumulo di questo tipo di fibrille".
Il Prof. Ehud Gazit, uno dei principali esperti di autoassemblaggio proteico dell'Università di Tel Aviv, ha aggiunto: "Questi risultati aggiungono un nuovo strato alla nostra comprensione della formazione di amiloide. Suggeriscono che proprietà fisiche come lo spin di elettroni - non solo le interazioni biochimiche - possono avere un ruolo significativo nel modo in cui si sviluppano queste strutture dannose. Ciò apre nuove possibilità per la progettazione di tecnologie che influenzano il comportamento proteico in modi mirati e non invasivi".
Uno sguardo al futuro: applicazioni e possibilità
Sebbene i risultati siano ancora nel regno della ricerca di base, indicano nuovi modi di pensare a come controllare l'aggregazione di proteine indesiderate. Il team suggerisce che un giorno si potrebbero usare materiali magnetizzati o polarizzati con spin - come nanoparticelle appositamente progettate o membrane di filtrazione - per influenzare o interrompere selettivamente la formazione di strutture amiloidi dannose. Tali tecnologie potrebbero trovare applicazioni non solo nel trattamento delle malattie neurodegenerative, ma anche nell'amiloidosi legata alla dialisi e ad altre condizioni mediche.
"Questo studio ci offre un nuovo strumento per sondare il modo in cui le proteine si uniscono", ha detto Kapon. "Speriamo che aiuti a guidare la ricerca futura su come rallentare, prevenire o deviare questi processi in modo controllato".
La ricerca si aggiunge a un corpo crescente di lavoro che esplora come le proprietà fisiche, oltre alle interazioni chimiche, possono influenzare il comportamento biologico. Sottolinea inoltre il valore della collaborazione interdisciplinare, unendo fisica, chimica e biomedicina.
Fonte: Hebrew University of Jerusalem via AlphaGalileo (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Y kapon, [+10], Y Paltiel. Controlling Amyloid Assembly Dynamics Using Spin Interfaces. ACS Nano, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV