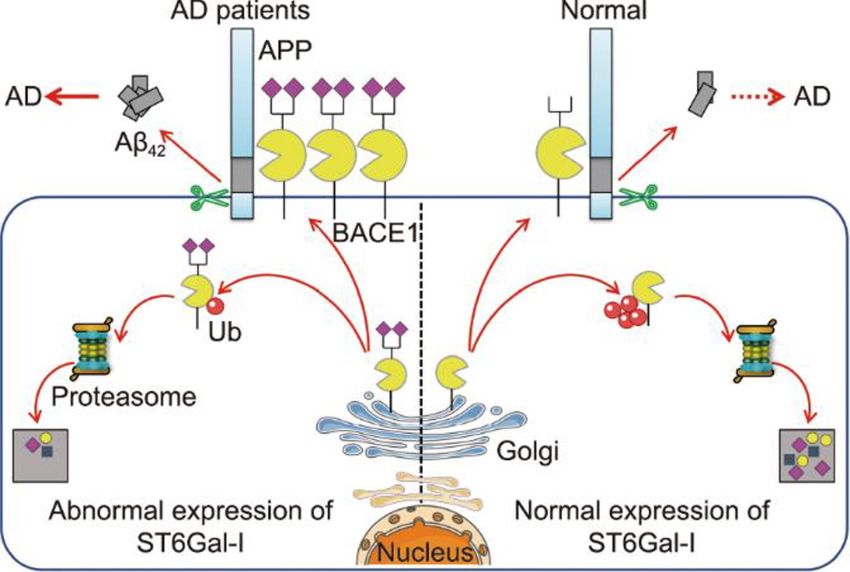
 Modello della disregolazione di BACE1 e della α2,6-siailazione nel MA (Fonte: Yang et al / Engineering)
Modello della disregolazione di BACE1 e della α2,6-siailazione nel MA (Fonte: Yang et al / Engineering)
Uno studio recente pubblicato su Engineering ha fornito nuove intuizioni sul coinvolgimento della sialilazione-α2,6 nel morbo di Alzheimer (MA), rivelando che l'ablazione della sialiltransferasi-I-α2,6 (ST6Gal-I), un enzima responsabile della sialilazione-α2,6, può sotto-regolare l'espressione del BACE1 e sopprimere la produzione di placche di amiloide-β42 (Aβ42), che sono segni distintivi del MA.
Il MA è un disturbo neurodegenerativo progressivo caratterizzato dalla graduale perdita di memoria e di funzioni cognitive. L'ipotesi amiloidogenica suggerisce che l'aggregazione delle placche Aβ è una guida patologica cruciale del MA. I peptidi Aβ sono generati dall'elaborazione sequenziale della proteina precursore amiloide (APP) da parte del 'sito-b dell'enzima 1 che scinde APP' (BACE1, b-site amyloid precursor protein cleaving enzyme 1) e della γ-secretasi.
Il BACE1 ha un ruolo cruciale nella biosintesi dei peptidi Aβ durante la patogenesi del MA. La glicosilazione, una modifica post-traduzionale che comporta l'aggiunta di oligosaccaridi alle proteine, è stata implicata nello sviluppo e nella progressione del MA, mentre era ancora poco chiaro il ruolo specifico nella malattia della sialilazione-α2,6, catalizzata da ST6Gal-I.
In questo studio, i ricercatori di molteplici istituzioni della Corea del Sud, che includono il Cancer Hospital della Shantou University e l'Institute for Genome Ingegnered Animal Models of Human Diseases della Dalian Medical University, hanno studiato l'espressione dei livelli di ST6Gal-I e i livelli di sialilazione-α2,6 nel fluido cerebrospinale (CSF) e nel siero di pazienti di MA, nonché in topi modello di MA. Hanno scoperto che sia l'espressione di ST6Gal-I che i livelli di sialilazione-α2,6 erano significativamente sovraregolati in questi campioni. Lo studio ha anche dimostrato che la delezione di ST6Gal-I nei ratti ha ridotto i livelli di BACE1 e alleviato il deterioramento dell'apprendimento e della memoria indotto dalla scopolamina, un farmaco usato per studiare i deficit cognitivi di tipo MA.
I ricercatori hanno usato la tecnologia di modifica genica CRISPR/CAS9 per generare ratti senza ST6Gal-I (ST6Gal-I-/-), che hanno livelli ridotti di sialilazione-α2,6 e una ridotta espressione di BACE1 nel cervello. Gli esperimenti comportamentali, come il test del labirinto d'acqua Morris, il test di costruzione del nido e il nuovo test di riconoscimento degli oggetti, hanno mostrato che, dopo il trattamento con scopolamina, i ratti ST6Gal-I-/- avevano disturbi cognitivi attenuati rispetto alle loro controparti naturali. Inoltre, lo studio ha rivelato che l'abbattimento di ST6Gal-I nelle cellule del neuroblastoma Neuro-2a ha ridotto l'espressione di BACE1 promuovendo la sua ubiquitinazione, portando a una ridotta produzione di Aβ42 e a minore apoptosi.
I risultati di questo studio evidenziano il ruolo significativo della sialilazione-α2,6 nello sviluppo e nella progressione del MA, suggerendo che ST6Gal-I potrebbe essere un potenziale obiettivo terapeutico per la diagnosi e il trattamento della malattia. Chiarendo il meccanismo attraverso il quale la sialilazione-α2,6 influisce sull'espressione di BACE1 e sulla produzione di Aβ42, questa ricerca apre nuove strade per esplorare gli approcci di glicomedicina per combattere il MA.
Studi futuri dovrebbero concentrarsi sull'approfondimento dei percorsi molecolari coinvolti nella regolazione della sialilazione-α2,6 e il suo impatto sulla patologia del MA, nonché sullo sviluppo di strategie terapeutiche che puntano ST6Gal-I per mitigare i deficit cognitivi associati al MA.
Fonte: Frontiers Journals via AlphaGalileo (> English) - Traduzione di Franco Pellizzari.
Riferimenti: K Yang, [+5], W Li. Ablation of ST6Gal-I Downregulates BACE1 Expression and Suppresses Production of Aβ42 Plaques in Alzheimer’s Disease. Engineering, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV