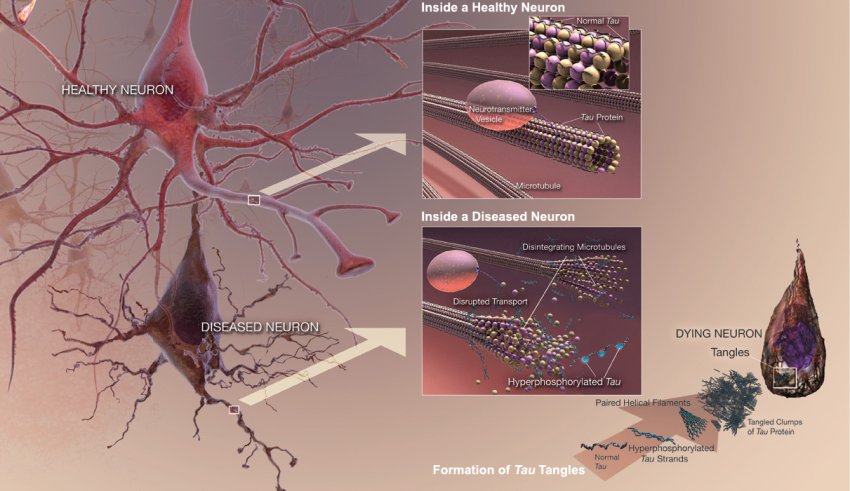
All'inizio del decorso dell'Alzheimer, molto prima che i futuri pazienti inizino a notare i sintomi, nelle loro cellule cerebrali iniziano a formarsi dei grovigli neurofibrillari composti da aggregati di proteine tau.
Quanto sono tossici questi aggregati e quanto si diffondono dipende dalle loro dimensioni. Tuttavia, gli scienziati che studiano la formazione dei grovigli non sono riusciti finora a spiegare perché nella malattia appaiono diverse dimensioni di aggregati tau simili a cavi.
Ma ora, i ricercatori dell'Ohio State University hanno scoperto che, invece di aumentare solo di una proteina alla volta, fibrille di varie lunghezze possono unirsi a un capo e all'altro per creare un filamento più lungo.
La scoperta, pubblicata sul Journal of Biological Chemistry, aiuta a spiegare come le fibrille possono crescere fino a centinaia di nanometri e potrebbe anche aiutare i ricercatori a capire i meccanismi di un gruppo emergente di candidati farmaci progettati per inibire l'aggregazione della tau.
Gli scienziati possono usare modelli matematici per descrivere processi biologici come la formazione di fibrille. Un modello semplice comune di aggregazione della tau include due passaggi. Nella prima fase, due proteine tau si legano lentamente e, nella seconda fase, ulteriori molecole di tau si agganciano rapidamente.
La prima autrice Carol Huseby, dottoranda del laboratorio di Jeff Kuret, in collaborazione con Ralf Bundschuh, si è proposta di espandere questo modello matematico per includere altri modi noti con cui si comportano le fibrille tau. Gli scienziati hanno osservato, ad esempio, che a volte una fibrilla si frammenta in due. Altre volte, una nuova fibrilla può nuclearsi nel mezzo di una fibrilla esistente.
Il semplice modello in due fasi prevedeva che una provetta riempita con proteina tau purificata provocasse un gran numero di fibrille corte. Ma la Huseby ha capito che quando i ricercatori esaminano la proteina tau aggregata al microscopio, vedono un minor numero di fibrille lunghe.
Quella discrepanza ha suggerito che qualcosa stava accadendo nel mondo reale che non era stato tenuto in considerazione nel modello. Hanno ipotizzato che forse le fibrille corte potevano attaccarsi da una parte e dall'altra, allungandosi.
La Huseby ha condotto una serie di esperimenti per testare l'ipotesi. In uno, prima ha marcato le proteine tau con tre diversi colori fluorescenti e ha permesso loro di aggregarsi in provette separate. Quindi ha mescolato insieme queste diverse fibrille colorate in una quarta provetta.
Le immagini scattate con un microscopio a fluorescenza a super risoluzione hanno mostrato fibrille lunghe con sezioni strette di ciascun colore, indicando che le fibrille delle provette originali devono avere le estremità unite per formare fibrille più lunghe. Gli esperimenti di controllo hanno stabilito che ciò non può essere spiegato dalla preferenza delle molecole etichettate per le etichette simili.
Dopo che la Huseby ha incorporato questo nuovo meccanismo nel modello, ha prodotto una descrizione molto migliore di ciò che le proteine purificate di tau stavano realmente facendo mentre formavano gli aggregati. Questo studio è il primo a dimostrare che le fibrille possono allungarsi di più di una singola proteina tau alla volta.
I ricercatori di Alzheimer stanno ancora cercando di discernere se le fibrille tau sono una causa o solo un effetto della malattia. Una possibilità è che la trasmissione di fibrille da una cellula all'altra possa contribuire alla diffusione della malattia nel cervello. È improbabile che una fibrilla molto lunga, secondo Kuret, si diffonda in questo modo. "Ma una volta suddivisa in piccoli pezzi, questi possono diffondersi, facilitando il loro movimento da una cellula all'altra".
Questo studio ha usato solo un tipo di tau. Conosciamo 6 isoforme di diversa lunghezza e la fosforilazione e altri cambiamenti aumentano la complessità della proteina. I ricercatori hanno in programma di incorporare queste variabili nel lavoro futuro e di iniziare a utilizzare il modello per capire come gli inibitori della tau modificano il comportamento degli aggregati proteici.
Fonte: American Society for Biochemistry and Molecular Biology via EurekAlert! (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Carol J. Huseby, Ralf Bundschuh and Jeff Kuret. The role of annealing and fragmentation in human tau aggregation dynamics. J. Biol. Chem. 11 Feb 2019, DOI: 10.1074/jbc.RA118.006943
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.















 Associazione Alzheimer OdV
Associazione Alzheimer OdV