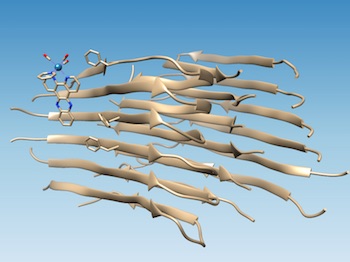
 Un complesso basato sul renio, sviluppato all'Università Rice, si lega alle fibrille del peptide amiloide-beta malformato, segnando il punto di una fenditura idrofobica che potrebbe diventare bersaglio di farmaci e ossida la fibrilla, cambiandone la chimica in modo da impedire l'ulteriore aggregazione. (Fonte: Marti Group)Una sonda inventata alla Rice University, che si accende quando si lega a un peptide amiloide-beta malformato (il tipo sospettato di causare l'Alzheimer), può identificare un sito specifico di legame sulla proteina, che potrebbe facilitare la progettazione di farmaci migliori per trattare la malattia.
Un complesso basato sul renio, sviluppato all'Università Rice, si lega alle fibrille del peptide amiloide-beta malformato, segnando il punto di una fenditura idrofobica che potrebbe diventare bersaglio di farmaci e ossida la fibrilla, cambiandone la chimica in modo da impedire l'ulteriore aggregazione. (Fonte: Marti Group)Una sonda inventata alla Rice University, che si accende quando si lega a un peptide amiloide-beta malformato (il tipo sospettato di causare l'Alzheimer), può identificare un sito specifico di legame sulla proteina, che potrebbe facilitare la progettazione di farmaci migliori per trattare la malattia.
Ancora meglio, con lo studio apparso sulla rivista Chem, il laboratorio ha scoperto che, quando la sonda metallica è illuminata, essa catalizza l'ossidazione della proteina in un modo che i ricercatori credono possa impedire alla proteina stessa di aggregarsi nel cervello dei pazienti.
Lo studio condotto su lunghe fibrille amiloidi conferma le simulazioni al computer dei colleghi dell'Università di Miami, che prevedevano che il complesso metallico fotoluminescente avrebbe potuto attaccarsi al peptide amiloide in prossimità di una fessura idrofoba (che evita l'acqua) che appare sulla superficie dell'aggregato fibrillare. Quella fessura può costituire un nuovo obiettivo per i farmaci.
Trovare il sito è stato relativamente semplice quando il laboratorio di Angel Martí, chimico della Rice, ha usato i suoi complessi a base di renio per puntare le fibrille. Il complesso di commutazione della luce si illumina quando è colpito con luce ultravioletta, ma quando si lega alle fibrille diventa 100 volte più luminoso e provoca l'ossidazione del peptide amiloide.
Martí dice:
"È come camminare sulla spiaggia. Puoi vedere che qualcuno è passato prima di te dalle impronte nella sabbia. Anche se non possiamo vedere il complesso del renio, possiamo trovare l'ossidazione (l'impronta) che produce sul peptide amiloide. Quella ossidazione accade solo accanto al punto in cui si lega. La vera importanza di questa ricerca è che ci permette di vedere con un alto grado di certezza dove le molecole possono interagire con le fibrille di amiloide-beta".
"Crediamo che questa fenditura idrofobica sia un sito di legame generale (sull'amiloide-beta) per le molecole. Questo è importante perché l'aggregazione dell'amiloide-beta è stata associata all'insorgenza dell'Alzheimer. Sappiamo che l'amiloide-beta fibrillare insolubile è tossica per le colture cellulari. Anche gli oligomeri amiloidi solubili, che sono fatti di diverse unità malripiegate di amiloide-beta, sono tossici per le cellule, probabilmente anche più delle fibrille.
"C'è un interesse a trovare farmaci che smorzano gli effetti deleteri degli aggregati di amiloide-beta. Ma per creare farmaci idonei, dobbiamo prima sapere come le medicine, o le molecole in generale, si legano e interagiscono con questi fibrille, e questo non era ancora chiaro. Ora abbiamo un'idea migliore di ciò che la molecola richiede per interagire con queste fibrille".
Quando i peptidi amiloidi si ripiegano correttamente, nascondono i loro residui idrofobici esponendo i loro residui idrofili (che attirano acqua) all'acqua. Ciò rende solubili le proteine, ha detto Martí. Ma quando l'amiloide-beta si piega male, lascia esposti due residui idrofobici, chiamati Valine 18 e fenilalanina 20, creando la spaccatura idrofobica. "È perfetto, perché allora le molecole con domini idrofobici sono guidate a legarsi lì", ha detto Martí. "[I residui idrofobici] sono compatibili con questa fessura idrofobica e associati alle fibrille, formando una forte interazione".
Se l'ossidazione risultante può impedire che le fibrille si aggreghino ulteriormente nella sostanza appiccicosa presente nel cervello dei pazienti di Alzheimer, può essere l'inizio di una strategia utile per fermare l'aggregazione prima che compaiano i sintomi della malattia.
"È un sistema molto attraente perché usa la luce, che è una risorsa economica", ha detto Martí. "Se potessimo modificare i complessi in modo da assorbire la luce rossa, che è trasparente al tessuto, potremmo essere in grado di eseguire queste modifiche fotochimiche negli animali vivi e forse un giorno nell'uomo".
Secondo lui l'attivazione della luce consente ai ricercatori di avere un "controllo fine" dell'ossidazione. "Immaginiamo che potrebbe essere possibile un giorno prevenire i sintomi di Alzheimer puntando l'amiloide-beta allo stesso modo in cui trattiamo il colesterolo nelle persone per prevenire le malattie cardiovascolari", ha detto Martí. "Sarebbe meraviglioso".
Fonte: Rice University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Amir Aliyan, Thomas J. Paul, Bo Jiang, Christopher Pennington, Gaurav Sharma, Rajeev Prabhakar, Angel A. Martí. Photochemical Identification of Molecular Binding Sites on the Surface of Amyloid-β Fibrillar Aggregates. Chem, 2017; DOI: 10.1016/j.chempr.2017.09.011
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali colelgamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV