 Riassunto grafico dello studio Prakash et al / Immunity
Riassunto grafico dello studio Prakash et al / Immunity
Si pensava da tempo che il grasso nel cervello non avesse alcun ruolo nelle malattie neurodegenerative, ma i ricercatori dell'Università Purdue (West Lafayette, Indiana) stanno sfidando tale assunzione. I risultati della loro ricerca, pubblicata su Immunity, mostrano che l'eccesso di grasso nelle cellule immunitarie residenti del cervello, chiamate microglia, compromette la loro capacità di combattere le malattie.
Questa intuizione apre la strada a terapie neuroimmuni basate su biologia lipidica che potrebbero trattare malattie come il morbo di Alzheimer (MA), migliorando la funzione microgliale e la salute dei neuroni. Questo lavoro è stato guidato da Gaurav Chopra, professore di chimica e da Margaret Tarpo, prof.ssa di chimica e di informatica della Purdue.
Mentre la maggior parte dello sviluppo di farmaci per il MA punta le patologie primarie della malattia, placche di una proteina mal ripiegata chiamata amiloide-beta (Aβ) e grovigli della proteina tau, Chopra si è concentrato sulle cellule anormalmente ricche di grassi che circondano le regioni malate del cervello. In un lavoro precedente pubblicato su Nature, Chopra e collaboratori avevano mostrato che, in presenza di una malattia, gli astrociti - un altro tipo di cellule di supporto dei neuroni - rilasciano un acido grasso che è tossico per le cellule cerebrali.
Anche un altro lavoro eseguito in collaborazione con l'Università della Pennsylvania, pubblicato lo scorso anno su Nature, ha collegato la disfunzione mitocondriale nei neuroni con depositi di grasso nelle cellule gliali durante l'invecchiamento, un importante fattore di rischio per la neurodegenerazione.
"A nostro avviso, puntare direttamente placche o grovigli non risolverà il problema; dobbiamo ripristinare la funzione delle cellule immunitarie nel cervello", ha detto Chopra. "Stiamo scoprendo che è cruciale ridurre l'accumulo di grasso nel cervello malato, poiché il grasso accumulato rende più difficile per il sistema immunitario fare il suo lavoro e mantenere l'equilibrio. Puntando questi percorsi, possiamo ripristinare la capacità delle cellule immunitarie, come le microglia, di combattere la malattia e mantenere il cervello in equilibrio, che è il loro compito".
Il team di Chopra ha lavorato in collaborazione con ricercatori della Cleveland Clinic guidata da Dimitrios Davalos, assistente professore di medicina molecolare. Chopra è anche direttore del Merck-Purdue Center e membro del Purdue Institute for Integrative Neuroscience, del Purdue Institute for Drug Discovery, del Purdue Institute of Inflammation, Immunology and Infectious Disease, e del Regenstrief Center for Healthcare Engineering.
Più di 100 anni fa, Alois Alzheimer ha identificato anomalie nel cervello di una donna con la malattia che ora porta il suo nome, che includono placche, grovigli e cellule piene di goccioline di composti grassi chiamati lipidi. Fino a poco tempo fa, queste goccioline lipidiche sono state trascurate come sottoprodotti della malattia. Ma i collegamenti che Chopra e il suo team hanno trovato tra malattia neurodegenerativa e grassi nelle microglia e negli astrociti, due tipi di cellule gliali che supportano i neuroni nel cervello, suggeriscono con forza il contrario. Chopra afferma che questa ricerca pone le basi per un "nuovo modello lipidico di neurodegenerazione". Gli piace chiamare questi accumuli di grasso 'placche lipidiche', poiché non assomigliano a goccioline sferiche.
"Non sono le goccioline lipidiche ad essere patogene, ma a far male è il loro accumulo. Pensiamo che la composizione delle molecole lipidiche che si accumulano all'interno delle cellule cerebrali sia una delle principali guide della neuroinfiammazione, che porta a diverse patologie, come invecchiamento, MA e altre condizioni collegate agli insulti infiammatori nel cervello. La composizione specifica di queste placche di lipidi può definire specifiche malattie cerebrali", ha dett Chopra.
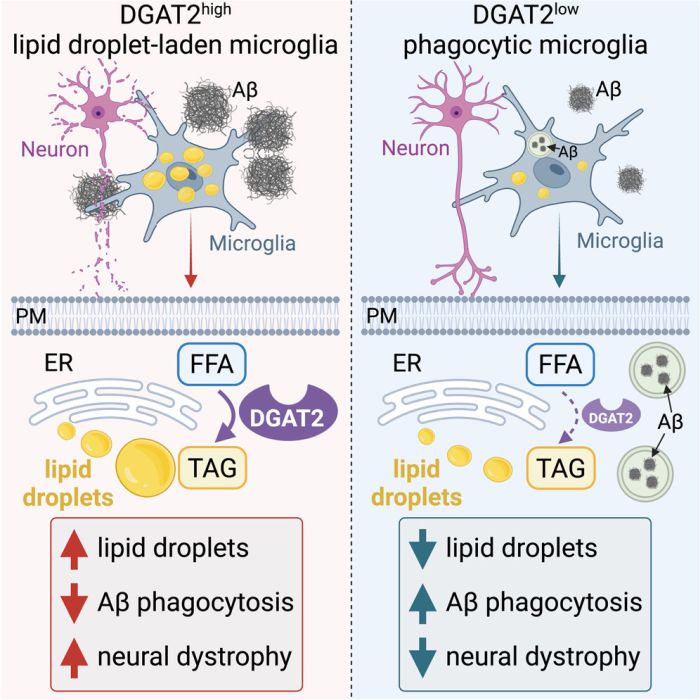
Lo studio su Immunity si concentra sulle microglia, le "cellule immunitarie vere e proprie del cervello", che eliminano i detriti, come le proteine mal ripiegate tipo Aβ e tau, assorbendole e scomponendole in un processo chiamato fagocitosi. Il team di Chopra ha esaminato le microglia in presenza di Aβ e si è posto una semplice domanda: cosa succede alle microglia quando entrano in contatto con l'Aβ?
Le immagini del tessuto cerebrale da persone con MA hanno mostrato placche Aβ circondate da microglia. Le microglia situate entro 10 micrometri da queste placche contenevano il doppio delle goccioline lipidiche rispetto a quelle più lontane. Queste microglia piene di gocce lipidiche più vicine alle placche hanno eliminato il 40% in meno di Aβ rispetto alle microglia normali del cervello senza malattia.
Nella loro indagine sul perché le microglia fossero compromessa nel cervello di MA, il team ha usato tecniche specializzate, scoprendo che le microglia a contatto con placche e infiammazione legata alla malattia hanno prodotto un eccesso di acidi grassi liberi. Mentre le microglia di norma usano acidi grassi liberi come fonte di energia - e una certa produzione di questi acidi grassi è persino benefica - Chopra e il suo team hanno scoperto che le microglia più vicine alle placche Aβ convertono questi acidi grassi liberi in triacilglicerolo, una forma immagazzinata di grasso, in così grandi quantità che diventano sovraccariche e immobilizzate dal proprio stesso accumulo. La formazione di queste goccioline lipidiche dipende dall'età e dalla progressione della malattia, diventando più evidente man mano che avanza.
Tracciando la complessa serie di passaggi usati dalle microglia per convertire gli acidi grassi liberi in triacilglicerolo, il team di ricerca è arrivato alla fase finale di questo percorso. Hanno trovato che livelli anormalmente alti di un enzima chiamato DGAT2 catalizzano l'ultimo passo della conversione degli acidi grassi liberi in triacilglicerolo. Si aspettavano di vedere livelli altrettanto alti del gene DGAT2 - poiché il gene doveva essere copiato per produrre la proteina - ma non era così. L'enzima si accumula perché non si degrada così rapidamente come farebbe normalmente, piuttosto che essere sovrapprodotto. Questo accumulo di DGAT2 fa sì che la microglia devii gli acidi grassi in deposito a lungo termine e accumulo di grassi invece di usarli per energia o riparazione.
"Abbiamo dimostrato che l'Aβ è direttamente responsabile del grasso che si forma all'interno delle microglia", ha detto Chopra. "A causa di questi depositi grassi, le cellule microgliali diventano disfunzionali: smettono di eliminare l'Aβ e smettono di fare il loro lavoro".
Chopra ha detto che i ricercatori non sanno ancora cosa rende così persistente l'enzima DGAT2. Tuttavia, nella loro ricerca di un rimedio, il team ha testato due molecole: una che inibisce la funzione di DGAT2 e un'altra che ne promuove il degrado. La degradazione dell'enzima DGAT2 è stata in definitiva benefica per ridurre il grasso nel cervello, migliorare la funzione delle microglia e la loro capacità di ingoiare placche di Aβ e migliorare i marcatori della salute neuronale nei modelli animali del MA.
"Quello che abbiamo visto è che quando puntiamo l'enzima che produce grassi e lo rimuoviamo o lo degradiamo, ripristiniamo la capacità delle microglia di combattere la malattia e mantenere l'equilibrio nel cervello, che è quello che devono fare", ha detto Chopra.
"Questa è una scoperta entusiasmante che rivela come una placca proteica tossica influenza direttamente il modo in cui si formano e sono metabolizzati i lipidi dalle cellule microgliali nel cervello di MA", ha affermato Priya Prakash, prima coautrice dello studio. "Mentre il lavoro più recente in questo settore si è concentrato sulle basi genetiche della malattia, la nostra ricerca apre la strada a capire come puntare i lipidi e i loro percorsi all'interno delle cellule immunitarie del cervello, per ripristinare la loro funzione e combattere la malattia".
3"È incredibilmente entusiasmante collegare il metabolismo dei grassi alla disfunzione immunitaria nel MA", ha affermato Palak Manchanda, l'altra prima coautrice. "Individuando questo onere lipidico e l'interruttore DGAT2 che lo guida, riveliamo una angolazione terapeutica completamente nuova: ripristinare il metabolismo microgliale e ripristinare la difesa del cervello dalla malattia".
Fonte: Mary Martialay in Purdue University (> English) - Traduzione di Franco Pellizzari.
Riferimenti:
- P Prakash, [+28], G Chopra. Amyloid-β induces lipid droplet-mediated microglial dysfunction via ... Immunity, 2025, DOI
- CN Byrns, [+14], NM Bonini. Senescent glia link mitochondrial dysfunction and lipid accumulation. Nature, 2024, DOI
- KA Guttenplan, [+13], BA Barres. Neurotoxic reactive astrocytes induce cell death via saturated lipids. Nature, 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV