Le proteine sono biomolecole vitali responsabili dell'esecuzione di varie funzioni nel corpo umano e sono quindi considerate i cavalli di lavoro di una cellula. La struttura primaria di una proteina è composta da diversi aminoacidi che si mettono insieme. La struttura così formata è quindi sottoposta a ripiegamento proteico, un processo attraverso il quale una proteina acquisisce la sua configurazione tridimensionale caratteristica e funzionale.
Questo stato, indicato come 'stato nativo', è cruciale per una corretta funzione proteica. Condizioni sfavorevoli, come stress o esposizione ad agenti esterni, possono indurre le proteine a piegarsi erroneamente e a formare aggregati, ostacolando la capacità di svolgere le proprie funzioni originali.
La piegatura errata (misfolding) delle proteine è stata implicata come causa sottostante di una serie di malattie umane, in particolare Alzheimer, Huntington e Parkinson. Inoltre, è noto anche che la formazione di aggregati ha un impatto sull'efficacia e sulla sicurezza dei farmaci basati su proteine. Ciò sottolinea la necessità di studiare composti e strategie in grado di sopprimere il misfolding e migliorare la stabilizzazione delle proteine.
Studi recenti hanno riferito la capacità di alcuni polimeri di stabilizzare le proteine, e tuttavia, il loro meccanismo d'azione e l'impatto delle interazioni tra componenti idrofobici (i componenti che respingono l'acqua) e le proteine non sono chiari.
Per affrontare questo divario di conoscenza, un team di ricercatori guidati dal professor Kazuaki Matsumura del Japan Advanced Institute of Science and Technology (JAIST) di Ishikawa/Giappone, che comprendeva l'ex assistente professore Robin Rajan e il dott. Dandan Zhao del JAIST e l'assistente professore Tadaomi Furuta del Tokyo Institute of Technology, ha condotto uno studio per chiarire il meccanismo della solfobetaina (SPB), un polimero zwitterionico, nell'inibire l'aggregazione delle proteine.
Nel loro studio pubblicato su Cell Reports Physical Science, i ricercatori hanno anche cercato di comprendere le interazioni specifiche che si verificano tra componenti idrofobici e proteine e il loro impatto sull'aggregazione delle proteine. Spiegando la logica alla base di questo studio, il prof. Matsumura afferma:
"In precedenza, avevamo condotto uno studio sulle polisulfobetaine (PSPB), un polimero zwitterionico che è costituito da gruppi funzionali con cariche sia positive che negative. Abbiamo scoperto che il polimero ha esibito un'efficienza eccezionale nel sopprimere l'aggregazione proteica. Tuttavia, restava da chiarire l'impatto dell'idrofobicità".
In questo studio, i ricercatori hanno sintetizzato PSPB con diversi pesi molecolari e hanno aggiunto quantità variabili di monomeri idrofobici, sia individualmente che con diverse catene alchiliche, attraverso un processo noto come reversible addition-fragmentation chain transfer polymerization (polimerizzazione da trasferimento della catena reversibile per frammentazione-addizione).
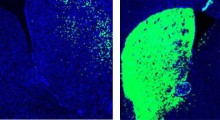
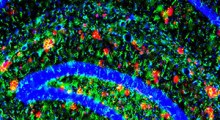
I ricercatori hanno quindi analizzato le proprietà stabilizzanti delle proteine di questi polimeri ed hanno esaminato le interazioni tra polimeri e proteine attraverso tecniche fisico-chimiche. I loro risultati hanno rivelato che i polimeri stabilizzano le proteine interrompendo percorsi importanti coinvolti nell'aggregazione delle proteine. In più, sia idrofobicità che peso molecolare hanno influenzato la prevenzione dell'aggregazione proteica e il miglioramento della stabilizzazione delle proteine.
L'aumento di questi fattori ha amplificato le interazioni deboli e reversibili tra SPB e proteine. "Possiamo pensare a questi polimeri come scudi molecolari reversibili, che interrompono il percorso di aggregazione", spiega il prof. Matsumura, nella discussione dei risultati dello studio. I ricercatori hanno anche scoperto che rimuovendo lo stress, è stato osservato un nuovo ripiegamento degli intermedi parzialmente non piegati, il che suggeriva il riacquisto dei loro stati nativi.
Pertanto, svelando gli intricati meccanismi molecolari della soppressione dell'aggregazione proteica da parte dei polimeri zwitterionici, questo studio pionieristico può aprire percorsi per nuove strategie terapeutiche che ritardano o prevengono le condizioni di malatia e contribuiscono a garantire la sicurezza dei farmaci a base di proteine.
Nelle parole del Prof. Matsumura, “In 5-10 anni, questa ricerca potrebbe portare allo sviluppo di nuovi trattamenti più efficaci per le condizioni relative all'errato ripiegamento delle proteine, migliorando significativamente gli esiti dei pazienti. Inoltre, può consentire la produzione di terapie proteiche più stabili ed economiche, a beneficio dell'industria farmaceutica e dei fornitori sanitari".
Fonte: JAIST-Japan Advanced Institute of Science and Technology via EurekAlert! (> English) - Traduzione di Franco Pellizzari.
Riferimenti: R Rajan, [+2], K Matsumura. Molecular mechanism of protein aggregation inhibition with sulfobetaine polymers and their hydrophobic derivatives. Cell Reports Physical Science, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV