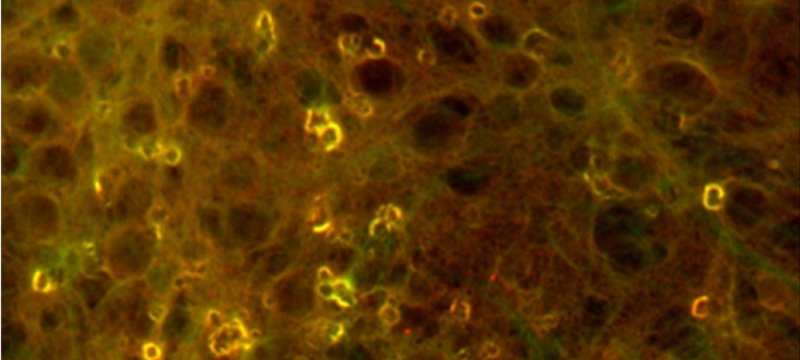
 Le fluorescenze sono concentrazioni di aggregati di proteina tau nel nucleo dei neuroni, una possibile causa dell'Alzheimer. Sui peptidi amiloide-beta, la modifica chimica alla lisina 16 può promuovere questi aggregati. (Fonte: Ashutosh Tiwari / Michigan Tech)
Le fluorescenze sono concentrazioni di aggregati di proteina tau nel nucleo dei neuroni, una possibile causa dell'Alzheimer. Sui peptidi amiloide-beta, la modifica chimica alla lisina 16 può promuovere questi aggregati. (Fonte: Ashutosh Tiwari / Michigan Tech)
A volte le proteine si piegano male. Quando ciò accade nel cervello umano, l'accumulo di proteine mal ripiegate può portare a malattie neurodegenerative come l'Alzheimer, il Parkinson e la SLA.
Le proteine non funzionano male, né si piegano in modo errato, di punto in bianco. C'è un delicato ecosistema di interazioni biochimiche e di ambienti, che di solito consentono loro di torcersi, dispiegarsi, ripiegarsi e fare il lavoro che si suppone debbano fare.
Tuttavia, come hanno verificato ricercatori dell'Università Tecnologica del Michigan in uno studio pubblicato su ACS Chemical Neuroscience, anche un piccolo cambiamento può provocare conseguenze a lungo termine.
Per i peptidi di amiloide-beta, considerati un importante segno distintivo del morbo di Alzheimer (MA), una modifica chimica comune a una particolare posizione sulla molecola ha un effetto farfalla che porta a errato ripiegamento, aggregazione e tossicità cellulare.
Acetilazione e tossicità dell'amiloide-beta
Ashutosh Tiwari, professore associato di chimica della Michigan Tech, spiega che le proteine amiloide-beta mal ripiegate tendono ad accumularsi e a formare aggregati, che possono formare fibrille filiformi o forme amorfe appallottolate.
Per capire che cosa provoca le diverse forme e valutare la loro tossicità, il gruppo di Tiwari si è rivolto all'acetilazione, una delle modificazioni chimiche più comuni subite dalle proteine, ma una delle meno studiate per la sua influenza sulla tossicità dell'amiloide-beta.
Sulle proteine amiloide-beta, l'acetilazione può avvenire in due siti: lisina 16 e lisina 28. Il gruppo ha scoperto che l'acetilazione nella lisina 16 porta agli aggregati disordinati che formano strutture amorfe appiccicose ma flessibili e ha livelli alti di tossicità. Hanno anche trovato che gli aggregati maggiore formazione di radicali liberi.
“Nessuno ha fatto uno studio sistematico per mostrare che acetilando l'amiloide-beta cambia il modo di presentarsi dell'aggregato, e poi cambia le sue proprietà biofisiche e quindi la tossicità”, ha detto Tiwari. “Stiamo dicendo che la forma, la viscosità e la flessibilità della struttura delle proteine aggregate possono avere un ruolo fondamentale nella tossicità cellulare e possono anche influenzare il meccanismo di tossicità”.
Aggregati e Alzheimer
Nel MA, questi aggregati si accumulano nella parte del cervello che colpisce la memoria. È una malattia che secondo l'Alzheimer's Association è la sesta causa di morte negli Stati Uniti e costerà alla nazione di circa $ 305 miliardi di dollari nel 2020. Tiwari dice che ciò che dobbiamo veramente capire della malattia è che non esiste una sola causa, nessun singolo grilletto, e probabilmente nessuna pallottola d'argento, a causa della chimica coinvolta.
“Questo è il modo in cui un sottile cambiamento in una singola posizione può influenzare l'aggregazione di un'intera proteina”, ha detto Tiwari, aggiungendo che l'effetto di acetilazione sulla Tau, un'altra aggregazione proteica, è stato di gran lunga più studiato dell'amiloide-beta. Inoltre, molti ricercatori continuano a pensare che una proteina mal ripiegata deve apparire in un certo modo per diventare problematica, e che le altre forme mal ripiegate sono un problema meno importante.
Tiwari è d'accordo che alcune delle modifiche delle proteine sono sottili, e paragona il distinguere le differenze ed i loro effetti ai pneumatici da neve. I pneumatici da neve hanno battistrada più profondi e un materiale più flessibile per gestire le strade invernali, ma è difficile notare quelle caratteristiche a velocità autostradale. Come tipi diversi di pneumatici, le forme di proteine possono apparire indistinguibili a distanza.
“Questo non è qualcosa che può essere visto da lontano, è una proprietà da toccare”, ha detto Tiwari. “Dobbiamo interrogare queste proprietà. Dobbiamo esaminare queste strutture più a fondo, sia nella morfologia che in prospettiva biofisica”.
Quando lo faremo, potremo comprendere meglio la complessità delle proteine mal ripiegate e la tossicità dell'amiloide-beta che possono causare malattie neurodegenerative come l'Alzheimer.
Fonte: Michigan Technological University (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Rashmi Adhikari, Mu Yang, Nabanita Saikia, Colina Dutta, Wafa Alharbi, Zhiying Shan, Ravindra Pandey, Ashutosh Tiwari. Acetylation of Aβ42 at Lysine 16 Disrupts Amyloid Formation. ACS Chemical Neuroscience, 24 Mar 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV