E' quasi un assioma che le proteine mal ripiegate compromettono il funzionamento normale delle cellule e che causano malattie umane debilitanti, ma finora non si capiva bene come queste proteine sono rilevate e degradate all'interno del corpo.
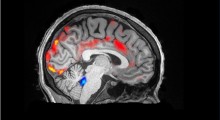
Le malattie neurodegenerative (che comprendono l'Alzheimer, il Parkinson, la sclerosi laterale amiotrofica o morbo di Lou Gehrig, l'Huntington e le atassie spino-cerebellari) esigono un pedaggio devastante dalla popolazione che invecchia in tutto il mondo.
"Eppure, non c'è praticamente nessuna cura per una qualsiasi di tali malattie e gli studi clinici hanno dato risultati per lo più deludenti, indicando che gli investigatori stanno ignorando qualcosa di fondamentale su queste malattie", dice Xiaolu Yang, PhD, professore di Biologia del Cancro alla Perelman School of Medicine dell'Università della Pennsylvania. Tutte queste malattie sono causate da un accumulo di proteine tossiche mal ripiegate in tipi diversi di neuroni. "Tuttavia, la nostra conoscenza è molto limitata circa il modo in cui le cellule normalmente rimuovono queste proteine, una questione fondamentale per capire cosa va storto nelle malattie neurodegenerative".
Yang e il primo autore Lili Guo, PhD, studente di dottorato nel laboratorio di Yang, hanno identificato un percorso di riciclaggio delle proteine nelle cellule di mammifero che rimuovono le proteine mal ripiegate. I risultati del loro studio compaiono oggi online su Molecular Cell in anticipo sull'edizione cartacea. Hanno anche dimostrato il ruolo di questo percorso nella protezione dalle malattie neurodegenerative in un modello animale. Guo è ora borsista postdottorato in un altro laboratorio della Perelman School.
Le proteine sono i cavalli da lavoro delle cellule. Sono le macromolecole più abbondanti, estremamente versatili nelle loro funzioni e criticamente importanti per quasi tutti i processi biologici. Tuttavia, le proteine sono anche molto inclini al misfolding [errata piegatura] a causa di mutazioni genetiche, imprecisioni sintetiche e danni irreparabili. Inoltre, l'emivita di molte proteine è relativamente breve, da pochi minuti ad alcune ore, necessitando di una sintesi continuata. Tale situazione pone un onere alla cellula per mantenere il controllo di qualità nel ripiegamento corretto delle proteine.
"Questo documento risolve una questione di lunga data nel controllo di qualità delle proteine; come vengono selezionate con precisione le proteine mal ripiegate per essere degradate", osserva Yang. "Questo sistema appena descritto potrebbe essere un obiettivo importante per il trattamento delle malattie neurodegenerative".
Riciclaggio in due fasi
In qualsiasi cellula che funziona normalmente, la qualità delle proteine è mantenuta da due sistemi:
- Il primo è costituito dalle proteine chaperone [=cicerone, guida], come dita che piegano la carta in forma di origami esse guidano le catene di aminoacidi a piegarsi nella forma corretta finale della proteina.
- Il secondo è il sistema di riciclaggio che elimina le proteine mal ripiegate e, infine, le scompone nei singoli aminoacidi. Questo sistema coinvolge il proteasoma, un complesso proteico presente in tutto il citoplasma e nel nucleo delle cellule. "Ma non è chiaro come sono riconosciute le proteine deformi e trasportate al proteasoma per essere degradate. Questo studio sposta il campo in avanti, perché abbiamo dimostrato che il sistema è comune a molti tipi di proteine mal ripiegate", osserva Yang.
Oltre a identificare passo-passo i giocatori molecolari del sistema che elimina le proteine mal ripiegate, i ricercatori hanno anche definito il metodo di azione del sistema: il meccanismo d'azione è un sistema di relè con due proteine.
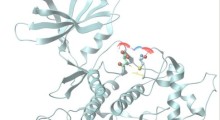
- La prima proteina (PML/TRIM19) riconosce le caratteristiche delle proteine mal ripiegate, come i nuclei interni esposti acqua-fobici, che emergono e aumentano la formazione di grumi proteici tossici. La PML interagisce selettivamente con le proteine mal ripiegate, riconoscendo questa, ed altre funzioni distinte, e marcano le proteine mal ripiegate con catene di una piccola proteina chiamata SUMO (small ubiquitin-like modifier, piccolo modificatore simil-ubiquitina).
- Le proteine mal ripiegate modificate con la SUMO vengono poi riconosciute dalla seconda proteina (RNF4) che le etichetta con catene di un'altra piccola proteina chiamata ubiquitina. La catena ubiquitina è un segnale che può essere riconosciuto da parte del proteasoma con forma a botte, che porta alla degradazione delle proteine mal ripiegate.
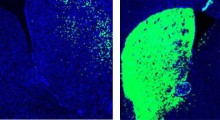
Il team ha poi continuato dimostrando l'importanza fisiologica del sistema di eliminazione, usando un modello di topo di atassia spinocerebellare 1 (SCA1), una malattia neurologica letale che causa problemi con il movimento e l'equilibrio. Causa della SCA1 sono delle mutazioni nel gene ATXN1, che coinvolgono segmenti ripetuti dei blocchi di costruzione del DNA citosina (C), adenina (A), e guanina (G) che compaiono più volte di fila nel gene, che codifica un tratto contiguo di aminoacidi glutammina.
Di norma il segmento CAG viene ripetuto da 4 a 39 volte all'interno del gene. Nella SCA1, il segmento CAG si ripete da 40 a più di 80 volte, il che porta ad un livello anomalmente lungo della proteina ataxina-1, che si ripiega in una forma tridimensionale sbagliata e forma grumi all'interno del nucleo. Il gruppo ha indicato che una carenza di PML aggrava sia i difetti comportamentali che quelli neuropatologici causati dalla ripetizione CAG espansa nel topo con SCA1, indicando che la PML funziona di norma per proteggere dalla neurodegenerazione.
La proteina PML è coinvolta anche nella formazione di tumori, ed è così che Yang, un biologo del cancro, è stato coinvolto in questo tipo di ricerca. "Le conoscenze acquisite da questo progetto ci forniscono ora la disponibilità di nuovi bersagli terapeutici per le malattie neurodegenerative. Forse nuovi farmaci potrebbero migliorare il sistema di eliminazione, aumentando l'azione della PML o della RNF4, o potrebbero bloccare gli inibitori del processo di codifica SUMO e dell'ubiquitina", dice Yang.
Hanno collaborato Alex Glavis-Bloom, Michael D. Brewer, James Shorter, Aaron D. Gitler, ora al Stanford Medical Center, e Benoit I. Giasson, ora all'Università della Florida. La ricerca è stata sostenuta in parte dal National Cancer Institute e dall'Istituto Nazionale delle Scienze Mediche Generali.
Fonte: Perelman School of Medicine at the University of Pennsylvania (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Lili Guo, Benoit I. Giasson, Alex Glavis-Bloom, Michael D. Brewer, James Shorter, Aaron D. Gitler, Xiaolu Yang. A Cellular System that Degrades Misfolded Proteins and Protects against Neurodegeneration. Molecular Cell, 2014; DOI: 10.1016/j.molcel.2014.04.030
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |






 Associazione Alzheimer OdV
Associazione Alzheimer OdV