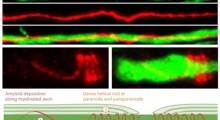
Al centro di malattie cerebrali come la sclerosi laterale amiotrofica (SLA), l'Alzheimer e il Parkinson c'è l'errato ripiegamento delle proteine (misfolding), per cui le proteine distorte non riescono a svolgere le loro funzioni normali.
Allo stato attuale, non c'è alcun modo conosciuto per invertire il misfolding proteico.
Ma James Shorter, PhD, professore associato di Biochimica e Biofisica alla Scuola Perelman di Medicina dell'Università della Pennsylvania, ha trovato un modo possibile per districare le proteine mal ripiegate "riprogrammando" l'Hsp104, una proteina comune del lievito. Il lavoro è stato pubblicato questa settimana in Cell.
L'Hsp104 è una proteina "chaperone" [=cicerone, guida], che aiuta formazione e funzionamento corretti di altri complessi proteici. Anche se l'Hsp104 è una delle proteine più comuni sul pianeta, non ha un analogo negli esseri umani o negli animali. "Non capiamo perché gli animali abbiano perso il gene dell'Hsp104, ma allo stesso tempo ci siamo chiesti se in questo fatto c'è una possibilità terapeutica", dice Shorter. "Possiamo ri-aggiungerlo come tecnologia dirompente per antagonizzare il misfolding proteico che caratterizza alcune malattie?".
In studi precedenti, il laboratorio di Shorter aveva stabilito che la versione naturale dell'Hsp104 è attiva contro le proteine neurodegenerative come l'alfa-sinucleina. "Abbiamo espresso la proteina originale [wild-type] in un modello di topo del Parkinson e abbiamo visto dei fenotipi benefici", spiega Shorter. "Ma la proteina wild-type non funziona come vorremmo".
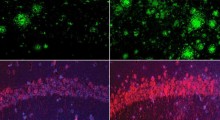
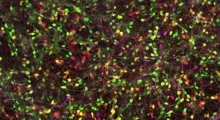
Nello studio attuale, il team ha esaminato grandi librerie di varianti di Hsp104 per trovare versioni che potrebbero sia mantenere la struttura delle proteine, sia romperne i grumi mal ripiegati. "Fortunatamente ne abbiamo trovato diverse varianti che potrebbero eliminare la tossicità associata a FUS, TDP-43, e proteine delle malattie da alfa-sinucleina nel lievito, raggruppate e malripiegate, migliorando anche la funzione della proteina corretta", aggiunge. Il team di Shorter ha collaborato con il laboratorio di Guy Caldwell della University of Alabama per testare le varianti di Hsp104 nel verme C.elegans e hanno trovato un marcato recupero di tossicità dell'alfa-sinucleina, la prima volta che enzimi ingegnerizzati hanno dimostrato di sopprimere una neurodegenerazione in un animale multicellulare.
"Questo è molto interessante, poichè non ci sono agenti conosciuti che liberano dalla neurodegenerazione e, al tempo stesso, invertono il misfolding proteico", osserva il primo autore Meredith Jackrel, PhD, un borsista postdottorato nel laboratorio di Shorter. "Certamente nessuno ha mai provato a riprogrammare una proteina esistente per cercare di realizzare questo compito".
Shorter ha identificato il dominio centrale avvolto a spirale dell'Hsp104 come un'area importante che incide sulla sua capacità di funzionare come chaperone, notando che mutazioni minori in questo campo sembrano avere un ampio potenziale per liberare le capacità di rompere i grumi proteici della molecola. Egli suggerisce che il dominio mediano dell'Hsp104 funzionerebbe proprio come un condensatore elettrico, immagazzinando le possibilità benefiche della proteina. Un aggiustamento apparentemente piccolo della struttura del dominio centrale, così come di altre parti della molecola (come le spirali dei pori), possono scatenare un potere terapeutico sorprendente.
Con il potere appena dimostrato nelle specie relativamente primitive dei vermi, il prossimo passo del team sarà di passare al modello animale più complesso dei topi, in cui gli effetti collaterali derivanti dall'introduzione di una proteina estranea nell'organismo può rappresentare un problema. Shorter spiega che, oltre alla funzione de-raggruppante dell'Hsp104, "l'altro grande obiettivo da un punto di vista bioingegneristico è ottimizzare l'Hsp104 modificato per l'obiettivo al quale si rivolge, perché tutte le varianti che abbiamo in questo momento sembrano funzionare in modo generico. Questo non è ciò che serve per avere un effetto terapeutico, perché ci potrebbero essere effetti fuori obiettivo".
Egli sottolinea che, sebbene il suo approccio di ri-progettazione proteica non sia ancora una cura o un trattamento pratico per malattie neurodegenerative, è un primo passo importante verso questo obiettivo finale e mostra che rompere i grumi - quello che si pensava impossibile - è a portata di mano, aggiungendo che "abbiamo definito che è possibile raggiungere l'attività di rottura dei grumi in un semplice sistema modello. La sfida è andare oltre".
La ricerca è stata finanziata dall'American Heart Association, dal National Institutes of Health e da altre istituzioni.
Fonte: Perelman School of Medicine at the University of Pennsylvania.
Riferimenti: Meredith E. Jackrel, Morgan E. DeSantis, Bryan A. Martinez, Laura M. Castellano, Rachel M. Stewart, Kim A. Caldwell, Guy A. Caldwell, James Shorter. Potentiated Hsp104 Variants Antagonize Diverse Proteotoxic Misfolding Events. Cell, 2014; 156 (1-2): 170 DOI: 10.1016/j.cell.2013.11.047
Pubblicato in uphs.upenn.edu (> English text) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |





 Associazione Alzheimer OdV
Associazione Alzheimer OdV