Un nuovo approccio mappa i cambiamenti dinamici nell’attività del proteoma nel tempo nelle strutture post-sinaptiche
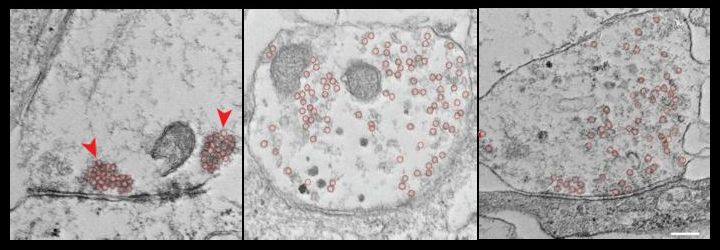 Immagini al microscopio elettronico delle sinapsi di neuroni umani dopo 7/14 giorni dall'esposizione di 30 minuti agli oligomeri tau o a un veicolo di controllo. Nei neuroni trattati con il veicolo le vescicole sinaptiche (cerchi rossi) sono raggruppate vicino alla zona attiva (frecce rosse), mentre i neuroni trattati con oligomeri tau mostrano un aumento del numero di vescicole con raggruppamento ridotto e una dispersione delle vescicole. Fonte: Pareja-Navarro et al / Mol Degen
Immagini al microscopio elettronico delle sinapsi di neuroni umani dopo 7/14 giorni dall'esposizione di 30 minuti agli oligomeri tau o a un veicolo di controllo. Nei neuroni trattati con il veicolo le vescicole sinaptiche (cerchi rossi) sono raggruppate vicino alla zona attiva (frecce rosse), mentre i neuroni trattati con oligomeri tau mostrano un aumento del numero di vescicole con raggruppamento ridotto e una dispersione delle vescicole. Fonte: Pareja-Navarro et al / Mol Degen
Un'indagine olistica sul modo in cui la tau tossica influisce sulle sinapsi spiega un po' meglio i processi che portano alla disfunzione neuronale e alla perdita di memoria nel morbo di Alzheimer (MA). Uno strumento, sviluppato nel laboratorio Tracy, consente ai ricercatori di monitorare i cambiamenti nel proteoma sinaptico, correlando i cambiamenti alla disregolazione sinaptica e alla perdita di sinapsi nel tempo. I risultati e lo strumento, a disposizione di tutti i ricercatori, sono ora online su Molecular Neurodegeneration.
"Non sono abbastanza le persone nel campo del MA a lavorare sulle sinapsi", afferma la prof.ssa Tara Tracy Ph, scienziata del Buck Institute for Research on Aging di Novato (California/USA), autrice senior dello studio. “Speriamo che il nostro strumento e le nostre nuove scoperte contribuiscano a cambiare la situazione”.
Le sinapsi sono le giunzioni tra le cellule nervose, minuscoli spazi attraverso i quali sono trasmessi segnali attraverso neurotrasmettitori. Il processo attraverso il quale si muovono questi segnali coinvolge sia le strutture sinaptiche pre ('inviano') che post ('ricevono'). La funzione pre- e post-sinaptica coordinata è essenziale per un'efficace trasmissione sinaptica e per la cognizione. Nei loro esperimenti, una breve esposizione di 30 minuti dei neuroni umani agli oligomeri tau tossici, che si accumulano nel cervello nel MA, è stata sufficiente per bloccare la plasticità sinaptica. I ricercatori hanno quindi iniziato a monitorare il modo in cui tale esposizione è progredita fino alla perdita di sinapsi.
"Dopo quell'esposizione siamo stati in grado di monitorare l'attività su entrambi i lati della sinapsi", afferma la Tracy. "Ciò che abbiamo scoperto è stata una cascata dinamica di eventi che hanno sorprendentemente avuto un impatto iniziale sulle strutture post-sinaptiche. Non ci aspettavamo di vedere una cosa del genere".
La Tracy e il suo team, guidato dalla prima autrice, la ricercatore Kristeen Pareja-Navarro PhD, hanno sfruttato l'immunocitochimica, l'elettrofisiologia e la microscopia elettronica nel lavoro. Il team ha inoltre sviluppato un nuovo strumento che mappa i cambiamenti del proteoma in tempo reale a livello delle sinapsi.
"Una scoperta importante di questo lavoro è stata l'identificazione dei primi meccanismi post-sinaptici che vengono interrotti dagli oligomeri tau e il modo in cui si collegano al deterioramento prolungato delle sinapsi. Essere in grado di studiare questi percorsi in modo più dettagliato è un passo importante verso la prevenzione della disfunzione sinaptica guidata dalla tau", afferma Pareja-Navarro. “Questo è l’obiettivo finale e la fase successiva della nostra ricerca”.
Con tutti gli strumenti a disposizione, il team ha delineato l’impatto della breve esposizione agli oligomeri tau sui neuroni nel tempo, fino a 14 giorni. Il nuovo approccio di etichettatura di prossimità che punta la post-sinapsi, ha permesso al team di osservare un'immediata sotto-regolazione post-sinaptica delle proteine motorie (miosina-Va e miosina IIb) che coincideva con una compromissione della plasticità sinaptica. Ciò è stato seguito, 24 ore dopo, dalla sovra-regolazione delle proteine correlate alla malattia (inclusa GSK3b), nei siti post-sinaptici, un risultato che Tracy descrive come “sorprendente, dato che il rimodellamento post-sinaptico che si è verificato a 24 ore era completamente diverso dalla risposta iniziale agli oligomeri tau”.
Sette giorni dopo l'esposizione all'oligomero tau, il team ha osservato una perdita di strutture post-sinaptiche sui neuroni, mentre la perdita di strutture pre-sinaptiche è stata rilevata dopo 14 giorni. "Un indebolimento della forza sinaptica indotto dalla tau potrebbe causare la perdita di queste connessioni", afferma la Tracy, sottolineando che le sinapsi rimanenti avevano recettori post-sinaptici ridotti, plasticità compromessa e raggruppamento anormale di vescicole sinaptiche ai terminali pre-sinaptici.
La maggior parte delle ricerche sulla perdita di sinapsi nelle malattie neurodegenerative coinvolgeva finora l’osservazione dei cambiamenti in un solo momento. Ora che gli scienziati hanno la capacità di osservare i cambiamenti nel proteoma sinaptico nel corso del tempo, la Tracy pensa che sia tempo che questo campo dia uno sguardo nuovo al ruolo delle sinapsi e alla loro funzione nelle malattie neurodegenerative.
"Studi precedenti si erano concentrati sul ruolo delle glia nell'eliminazione delle sinapsi, dimostrando che le glia possono rispondere alla tossicità della tau tagliando le sinapsi. Sono sicura che le glia fanno parte del processo di degenerazione delle sinapsi, ma il nostro lavoro scopre l'importanza fondamentale dei meccanismi intrinseci delle sinapsi nel causare la loro stessa perdita, che è in gran parte finora sotto-esplorata", afferma. "Gli oligomeri tau indeboliscono le sinapsi, ma il destino delle sinapsi diverge. Non tutte le sinapsi si perdono. Alcune si conservano anche se sono disfunzionali. Il fatto che sia i compartimenti pre- che quelli post-sinaptici cambino progressivamente nel tempo suggerisce che vari meccanismi importanti sono in gioco nel determinare il destino di una sinapsi".
Fonte: Buck Institute for Research on Aging (> English) - Traduzione di Franco Pellizzari.
Riferimenti: KA Pareja-Navarro, [+12], TE Tracy. Tau oligomers modulate synapse fate by eliciting progressive bipartite synapse dysregulation and synapse loss. Mol Neurodeg, 2026, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV