 Helicobacter pylori
Helicobacter pylori
Ogni tre secondi, qualcuno nel mondo sviluppa la demenza, della quale il morbo di Alzheimer (MA) è la forma più comune, rappresentando il 60/70% di tutti i casi. Sebbene gli scienziati abbiano fatto progressi significativi nella comprensione della malattia, non esiste ancora una cura. Ciò è in parte dovuto al fatto che il MA ha molteplici cause, molte delle quali non sono ancora completamente comprese.
Due proteine con ruoli centrali nel MA sono amiloide-beta (Aβ) e tau. L'Aβ forma placche appiccicose all'esterno delle cellule cerebrali, che interrompono la comunicazione tra i neuroni. La tau si accumula all'interno delle cellule cerebrali, dove si attorciglia in grovigli, portando infine alla morte cellulare. Queste placche e grovigli sono le caratteristiche del MA.
Questa comprensione, nota come ipotesi amiloide, ha modellato la ricerca per decenni e ha portato a trattamenti che puntano a eliminare l'Aβ dal cervello. A tale scopo sono stati approvati farmaci anticorpi monoclonali, che però funzionano solo nelle prime fasi della malattia; non invertono i danni esistenti e possono causare gravi effetti collaterali come gonfiore e sanguinamento nel cervello. Ancora più importante, puntano solo l'Aβ, lasciando la tau intatta.
Ma con una svolta sorprendente, una ricerca recente (vedi rif.) pubblicata con i miei colleghi ha scoperto che una proteina dall'Helicobacter pylori (un batterio noto per causare ulcere allo stomaco) può bloccare l'accumulo tossico sia di Aβ che di tau. Questa scoperta inaspettata può indicare una nuova strategia per la lotta contro il MA.
La nostra scoperta è iniziata da una domanda molto diversa. Inizialmente stavamo studiando come l'H pylori interagisce con altri microbi. Alcuni batteri formano comunità protettive chiamate biofilm, che si basano su insiemi di amiloide (simili nella struttura alle placche che si formano nel cervello) come impalcatura strutturale. Questo ci ha portato a chiederci: l'H pylori potrebbe influenzare i biofilm batterici interferendo anche con insiemi amiloidi nell'uomo?
Abbiamo rivolto la nostra attenzione a una nota proteina H pilori chiamata CagA. Mentre la metà della proteina (regione C-terminale) è nota per innescare effetti dannosi nelle cellule umane, l'altra metà (regione N-terminale) può avere proprietà protettive. Con nostra sorpresa, questo frammento N-terminale, chiamato CagAN, ha ridotto drasticamente la formazione di amiloidi batterici e biofilm nelle specie batteriche Escherichia coli e Pseudomonas.
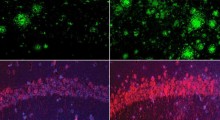
Incoraggiati da questi risultati, abbiamo testato se lo stesso frammento di proteina potesse bloccare l'accumulo di proteine Aβ umane. Per fare ciò, abbiamo incubato molecole di Aβ in laboratorio: alcune sono state trattate con CagAN, mentre altre sono rimaste normali. Abbiamo quindi monitorato la formazione di amiloide usando un lettore di fluorescenza e un microscopio elettronico. Abbiamo scoperto che i campioni trattati avevano molta meno formazione di ciuffi amiloidi durante il periodo di test. Anche a concentrazioni molto basse, il CagAN ha quasi completamente impedito all'Aβ di formare aggregati amiloidi.
Per capire come ha funzionato CagAN, abbiamo usato la risonanza magnetica nucleare (che ci consente di esaminare come le molecole interagiscono tra loro) per esaminare come la proteina interagisce con l'Aβ. Abbiamo anche usato la modellazione di computer per studiare possibili meccanismi. Sorprendentemente, CagAN ha anche bloccato l'aggregazione di tau, suggerendo che agisce su più proteine tossiche coinvolte nel MA.
Bloccare la malattia
Il nostro studio ci ha dimostrato che un frammento della proteina di Helicobacter pylori può bloccare efficacemente l'accumulo delle due proteine implicate nel MA. Ciò suggerisce che le proteine batteriche - o dei farmaci modellati su di loro - potrebbero un giorno bloccare i primi segni di MA.
Inoltre, i benefici possono estendersi oltre il MA. In ulteriori esperimenti, lo stesso frammento batterico ha bloccato l'aggregazione di IAPP (una proteina coinvolta nel diabete di tipo 2) e alfa-sinucleina (legata al Parkinson). Tutte queste condizioni sono guidate dall'accumulo di aggregati amiloidi tossici. Che un singolo frammento batterico possa interferire con così tante proteine suggerisce un entusiasmante potenziale terapeutico. Sebbene queste condizioni influenzino parti diverse del corpo, possono essere collegate attraverso il dialogo incrociato tra le proteine amiloidi, un meccanismo condiviso che CagAN potrebbe aiutare a rompere.
Certo, è importante essere chiari: questa ricerca è ancora in fase iniziale. Tutti i nostri esperimenti sono stati condotti in ambito di laboratorio, non ancora su animali o umani. Tuttavia, i risultati aprono un nuovo percorso. Il nostro studio ha anche scoperto i meccanismi sottostanti che permettono a CagAN di impedire ad Aβ e tau di formare aggregati amiloidi. Uno dei modi con cui CagAN agisce è impedire alle proteine di unirsi per formare ciuffi. Impedisce anche la formazione di piccoli aggregati di amiloidi prematuri. In futuro, continueremo lo studio dettagliato del meccanismo e valuteremo gli effetti nei modelli animali.
Questi risultati suscitano una domanda: l'H pylori, da sempre visto solo come dannoso, potrebbe anche avere un lato protettivo? Alcuni studi hanno suggerito una connessione tra l'infezione da H pylori e il MA, sebbene la relazione rimanga poco chiara. La nostra scoperta aggiunge un nuovo livello a questa discussione, suggerendo che parte di H pylori può effettivamente interferire con gli eventi molecolari che portano al MA.
Ciò significa che in futuro, potrebbe essere necessario adottare un approccio più preciso e personalizzato: invece di puntare a eliminare completamente H pylori con antibiotici, potrebbe essere più importante capire, in diversi contesti biologici, quali parti del batterio sono dannose e quali in realtà utili. Mentre la medicina continua a muoversi verso una maggiore precisione, l'obiettivo potrebbe non essere più spazzare via ogni microbo, ma capire come alcuni di loro lavorano con noi piuttosto che contro di noi.
Fonte: Gefei Chen (Professore associato, Karolinska Institutet, Stoccolma, Svezia) in The Conversation (> English) - Traduzione di Franco Pellizzari.
Riferimenti: J Zhen, [+15], G Chen. Helicobacter pylori CagA protein is a potent and broad-spectrum amyloid inhibitor.Sci. Adv., 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV