Un nuovo trattamento intrappola e neutralizza le proteine tossiche per fermare la progressione della malattia
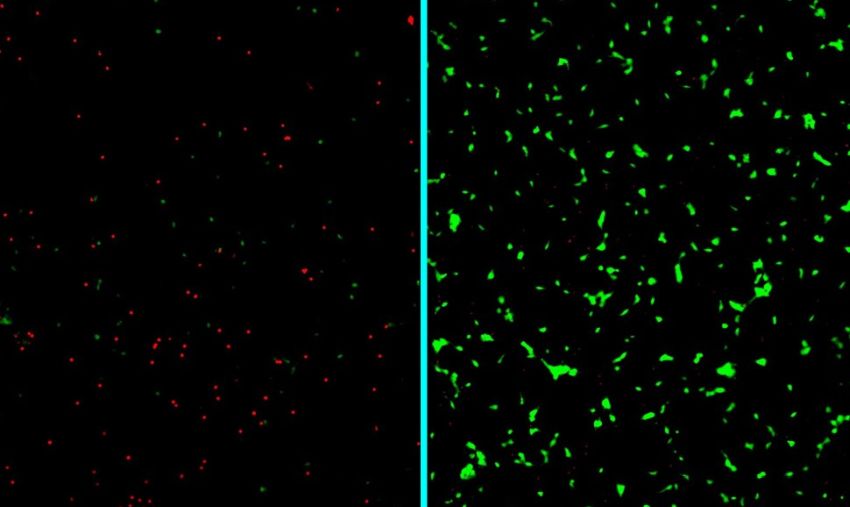 Micrografie di neuroni umani esposti ad amiloide-beta, non trattati e morti (rossi, a sinistra) o trattati con la nuova nanoterapia sviluppata alla Northwestern e rimasti vivi (verdi, a destra). Fonte: Samuel Stupp Lab / Northwestern University
Micrografie di neuroni umani esposti ad amiloide-beta, non trattati e morti (rossi, a sinistra) o trattati con la nuova nanoterapia sviluppata alla Northwestern e rimasti vivi (verdi, a destra). Fonte: Samuel Stupp Lab / Northwestern University
Scienziati della Northwestern University di Evanston (Illinois/USA) hanno sviluppato un nuovo approccio che combatte direttamente la progressione delle malattie neurodegenerative come il morbo di Alzheimer (MA) e la sclerosi laterale amiotrofica (SLA). In queste malattie devastanti, delle proteine si piegano male e si raggruppano attorno alle cellule cerebrali, portando infine alla morte di queste ultime.
Il nuovo trattamento innovativo intrappola efficacemente le proteine prima che possano aggregarsi in strutture tossiche in grado di penetrare nei neuroni. Le proteine intrappolate si degradano poi nel corpo. La strategia di 'pulizia' ha aumentato significativamente la sopravvivenza dei neuroni umani coltivati in laboratorio sotto stress da proteine che causano la malattia.
Samuel I. Stupp della Northwestern, pioniere nella medicina rigenerativa, professore di scienze dei materiali, di ingegneria, chimica, medicina e ingegneria biomedica della Northwestern e direttore-fondatore del Center for Rigenerative Nanomedicine (CRN), nonché autore senior dello studio pubblicato sul Journal of American Chemical Society, ha affermato:
"Il nostro studio evidenzia l'entusiasmante potenziale di nanomateriali molecolarmente progettati per affrontare le cause alla radice delle malattie neurodegenerative. In molte di queste malattie, le proteine perdono la loro struttura funzionale piegata e si aggregano per realizzare fibre distruttive che entrano nei neuroni e sono altamente tossiche per loro.
"Intrappolando le proteine mal ripiegate, il nostro trattamento inibisce la formazione di quelle fibre in una fase precoce, dove le fibre amiloidi corte, che penetrano nei neuroni, sono ritenute le strutture più tossiche. Con ulteriore lavoro, pensiamo che ciò potrebbe ritardare significativamente la progressione della malattia".
Il gruppo Stupp ha guidato lo sviluppo e la caratterizzazione dei nuovi materiali terapeutici. La coautrice Zaida Alvarez, ricercatrice dell'Institute for Bioengineering of Catalonia (IBEC) in Spagna, ex post-dottorato nel laboratorio di Stupp e attuale studiosa in visita al CRN, ha condotto test della terapia nei neuroni umani.
Una soluzione rivestita di zucchero
Secondo l'Organizzazione Mondiale della Sanità, ben 50 milioni di persone in tutto il mondo potrebbero avere un disturbo neurodegenerativo. La maggior parte di queste malattie sono caratterizzate dall'accumulo di proteine mal ripiegate nel cervello, che portano alla progressiva perdita di neuroni. I trattamenti attuali offrono un sollievo limitato, quindi rimane un disperato bisogno di nuove terapie.
Per affrontare questa sfida, i ricercatori si sono rivolti a una classe di anfifili peptidici, dei quali il laboratorio di Stupp è pioniere, che contengono catene modificate di aminoacidi. Gli anfifili peptidici sono già usati in prodotti farmaceutici noti, come il semaglutide (Ozempic). In effetti, gli investigatori della Northwestern hanno sviluppato una molecola simile nel 2012 che aumenta la produzione di insulina.
"Il vantaggio dei farmaci a base di peptidi è che si degradano in sostanze nutritive", ha detto Stupp. "Le molecole di questo nuovo concetto terapeutico si rompono in innocui lipidi, aminoacidi e zuccheri. Ciò significa che ci sono meno effetti collaterali avversi".
Nel corso degli anni, il gruppo di ricerca di Stupp ha progettato molti materiali a base di peptidi per diversi scopi terapeutici. Per sviluppare un anfifilo peptidico che tratta le malattie neurodegenerative, il suo team ha aggiunto un ingrediente extra: uno zucchero naturale chiamato trealosio.
"Il trealosio è presente naturalmente in piante, funghi e insetti", ha detto Zijun Gao, dottoranda del laboratorio di Stupp, prima autrice dello studio. "Li protegge dal cambiamento delle temperature, in particolare da disidratazione e congelamento. Altri hanno scoperto che il trealosio può proteggere molte macromolecole biologiche, comprese le proteine. Quindi, volevamo capire se potevamo usarlo per stabilizzare le proteine mal ripiegate".
L'instabilità è la chiave
Quando sono stati aggiunti all'acqua, gli anfifili peptidici si sono autoassemblati in nanofibre rivestite di trealosio. Sorprendentemente, il trealosio ha destabilizzato le nanofibre. Sebbene sembri controintuitivo, questa ridotta stabilità ha mostrato effetti benefici.
Di per sé, le nanofibre sono forti e ben ordinate, e resistono alla riorganizzazione della loro struttura. Ciò rende più difficile per altre molecole, come le proteine mal ripiegate, integrarsi nelle fibre. Le fibre meno stabili, d'altra parte, sono diventate più dinamiche e con più probabilità di trovare e interagire con le proteine tossiche.
"Insiemi instabili di molecole sono molto reattivi", ha detto Stupp. "Vogliono interagire e legarsi con altre molecole. Se le nanofibre fossero stabili, sarebbero felici di ignorare tutto ciò che le circonda".
Alla ricerca di stabilità, le nanofibre si sono legate alle proteine di amiloide-beta (Aβ), un colpevole cruciale implicato nel MA. Ma le nanofibre non hanno semplicemente impedito alle proteine di Aβ di raggrupparsi insieme. Le nanofibre hanno incorporato pienamente le proteine nelle loro stesse strutture fibrose, intrappolandole permanentemente in filamenti stabili.
"Quindi, non è più una fibra anfifilo peptidico", ha detto Stupp. “Ma una nuova struttura ibrida che comprende sia l'anfifilo peptidico che l'Aβ. Ciò significa che le cattive proteine di Aβ, che avrebbero formato fibre amiloide, sono intrappolate. Non possono più penetrare nei neuroni e ucciderli. È come una squadra di pulizia delle proteine mal ripiegate. Questo è un nuovo meccanismo per affrontare la progressione delle malattie neurodegenerative, come il MA, in una fase precoce. Le terapie attuali si basano sulla produzione di anticorpi per fibre amiloidi ben formate".
Migliorare la sopravvivenza dei neuroni
Per valutare il potenziale terapeutico del nuovo approccio, gli scienziati hanno condotto test di laboratorio usando neuroni umani derivati da cellule staminali. I risultati hanno mostrato che le nanofibre rivestite di trealosio hanno migliorato significativamente la sopravvivenza dei neuroni motori e corticali quando esposti alla proteina tossica Aβ.
Stupp afferma che il nuovo approccio con l'uso di nanofibre instabili per intrappolare le proteine offre una strada promettente per sviluppare terapie nuove ed efficaci per MA, SLA e altre condizioni neurodegenerative. Proprio come i trattamenti per il cancro combinano terapie multiple - chemio, chirurgia o terapia ormonale e radiazioni - Stupp ha affermato che la nanoterapia potrebbe essere più efficace se combinata con altri trattamenti.
"La nostra terapia potrebbe funzionare meglio quando si puntano le malattie in una fase precoce, prima che le proteine aggregate entrino nelle cellule", ha detto Stupp. "Ma è difficile diagnosticare queste malattie nelle prime fasi. Quindi, potrebbe essere combinata con terapie che colpiscono i sintomi della fase successiva della malattia. Quindi, potrebbe essere un doppio colpo".
Fonte: Amanda Morris in Northwestern University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Z Gao, [+8], SI Stupp. Supramolecular Copolymerization of Glycopeptide Amphiphiles and Amyloid Peptides Improves Neuron Survival. J Am Chem Soc, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV