Il morbo di Alzheimer (MA) è una condizione neurologica che porta alla demenza che peggiora con l'età, quando i pazienti presentano deficit cognitivi, di memoria e psicologici. Mentre le terapie attuali si concentrano sull'alleviare in una certa misura questi sintomi, il MA non ha né prevenzione né cura definite, suggerendo la necessità di continui sforzi verso la comprensione della biologia della malattia.
L'accumulo di fibrille composte dalla proteina amiloide-β (Aβ) patogena sotto forma di placche nel cervello è un segno distintivo del MA. Decifrare la sua organizzazione strutturale è quindi cruciale per progettare trattamenti mirati contro la malattia.
Mentre sono state riferite diverse forme (polimorfi) della specie Aβ40 della proteina, sono rimaste più sconosciute le specie più patogene dell'Aβ42. Inoltre, rimane ancora difficile caratterizzare le tracce di Aβ da piccoli campioni con tecniche analitiche standard.
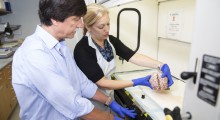
Pertanto, un team di ricercatori del Tokyo Institute of Technology, del RIKEN, dell'Università dell'Illinois di Chicago e dell'Università di Chicago, guidato dal prof. Yoshitaka Ishii, ha testato l'applicabilità della spettroscopia a risonanza magnetica nucleare a stato solido (SSNMR, solid-state nuclear magnetic resonance) per decifrare le differenze strutturali a livello atomico del'Aβ e delle fibrille patogene associate.
I risultati, pubblicati sul Journal of American Chemical Society, evidenziano questa potente tecnica analitica che misura i comportamenti differenziali e le proprietà dei nuclei sotto l'influenza dei campi magnetici ed elettrici, evidenziando la loro struttura atomica.
Spiegando ulteriormente lo studio, il prof. Ishii afferma:
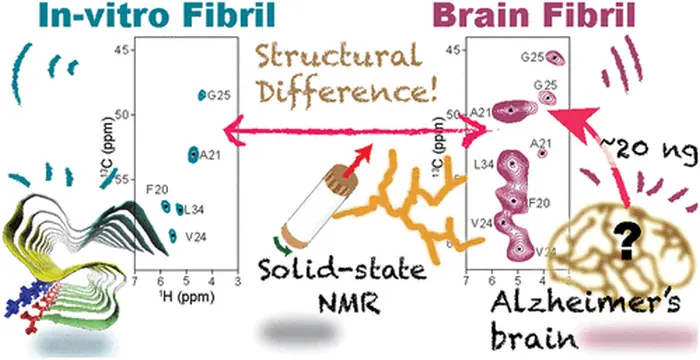
"Sono disponibili informazioni limitate sulle variazioni strutturali delle fibrille Aβ42 preparate in condizioni fisiologicamente rilevanti, nonostante la loro importanza patologica. Nel nostro studio, dimostriamo l'uso di SSNMR rilevato con 1H (isotopo di idrogeno) nella caratterizzazione delle fibrille Aβ derivate dal paziente, oltre a quelle sintetiche, in quantità limitate da pico- a nano-moli [di idrogeno]".
La SSNMR rilevata con 13C (isotopo di carbonio), che di solito si usa per caratterizzare la struttura, richiede grandi quantità di campioni e presenta difficoltà nella preparazione di campioni omogenei. Data la maggiore sensibilità e facilità di analizzare le tracce nei campioni biologici, i ricercatori hanno usato la sensibilità migliorata dalla SSNMR rilevata da 1H per la loro analisi.
Le fibrille di Aβ, sintetiche e derivate dal cervello di un paziente con MA, sono state etichettate con isotopi 13C e 15N in residui di amminoacidi specifici per una migliore sensibilità, risoluzione atomica e analisi strutturale specifica del sito.
Il team è riuscito a caratterizzare con successo un nuovo polimorfo di Aβ42 usando l'approccio sopra menzionato, con solo circa 42 Nmol di Aβ-25 a concentrazioni 100 volte inferiori di quelle usate in precedenza. Inoltre, la migliore sensibilità ha diminuito significativamente il tempo necessario per ottenere gli spettri dei campioni. Le posizioni spettrali ottenute da questa tecnica hanno rivelato che la struttura della spina dorsale della proteina e la disposizione delle catene laterali sono diverse dalle strutture conosciute finora.
Nel complesso, lo studio chiarisce i contatti molecolari coinvolti nella stabilizzazione delle fibrille Aβ42 patogene, preparando così la strada a nuove strategie terapeutiche che possono puntare questi aggregati tossici che guidano la progressione del MA.
Il prof. Ishii conclude citando le applicazioni cliniche di queste scoperte:
"Il nostro studio dimostra la propensione dell'Aβ42 a formare molteplici forme di fibrille, nel cervello e nei preparati sintetici. Riteniamo che il nostro studio possa aprire nuove strade per analizzare le tracce nei campioni biologici, come fibrille e oligomeri amiloidi, per i quali la SSNMR rilevata da 13C potrebbe non essere efficace".
Abbiamo veramente fatto un passo in più per capire questa malattia complessa!
Fonte: Tokyo Institute of Technology via EurekAlert! (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Ayesha Wickramasinghe, Yiling Xiao, Naohiro Kobayashi, Songlin Wang, Kathryn P. Scherpelz, Toshio Yamazaki, Stephen Meredith, Yoshitaka Ishii. Sensitivity-Enhanced Solid-State NMR Detection of Structural Differences and Unique Polymorphs in Pico- to Nanomolar Amounts of Brain-Derived and Synthetic 42-Residue Amyloid-β Fibrils. J. Am. Chem. Soc., 26 Jul 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.




 Associazione Alzheimer OdV
Associazione Alzheimer OdV