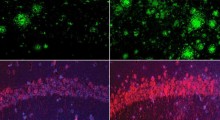
Immaginiamo il mostro di un film horror anni '50, un grumo di porcheria strisciante, gelatinosa, collosa, che strangola tutto quello che si trova intorno. Queste sono le placche amiloidi quando si formano nei tessuti del corpo dei malati di Alzheimer.
Questi grumi proteici appiccicosi sono associati a molte altre malattie croniche e debilitanti, tra cui il diabete di tipo 2 e le malattie neurodegenerative come il Parkinson e la corea di Huntington.
Le placche amiloidi sono un mistero da molti anni. Il medico tedesco Alois Alzheimer le ha notate per primo nel 1900 nel cervello di un paziente deceduto che aveva sperimentato una forma particolare di perdita di memoria e sbalzi d'umore, i sintomi della malattia che oggi porta il suo nome.
Qualche decennio fa, gli scienziati hanno determinato la struttura di base delle placche. Da allora, i ricercatori, molti finanziati dal National Institutes of Health, hanno fatto enormi passi avanti nella comprensione del ruolo di queste strutture nella malattia.
Malformazione caotica
Nella maggior parte delle proteine sane, una catena di piccole molecole, dette amminoacidi, si ripiega in modo preciso. Le proteine sono costituite da combinazioni di lunghe spirali rettilinee, perni, e larghe sezioni piane chiamate foglietti beta. Tutti questi pezzi devono essere nei posti giusti perchè una proteina svolga la sua funzione unica ed eviti di attaccarsi a se stessa o ad altre proteine.
Le placche amiloidi cominciano a formarsi all'esterno delle cellule quando una proteina si dispiega in risposta ad una mutazione o allo stress cellulare, come il calore. Mentre molte proteine si ripiegano in forma corretta, alcune assumono una piegatura errata. Nelle proteine che formano l'amiloide, sezioni di catene di aminoacidi (che normalmente non formano foglietti beta) si possono riaggregare in questa struttura piatta.
Quando questo accade, i foglietti beta possono accatastarsi uno sopra l'altro e incollarsi insieme. Anche solo un paio di foglietti beta impilati possono essere tossici: come un vampiro, possono bucare le membrane cellulari, causando la morte delle cellule. I foglietti beta amiloide possono accumularsi uno sull'altro quasi all'infinito, diventando lunghe catene che intrappolano la cellula, chiamate fibrille. Grumi di molte fibrille costituiscono le placche che sono il segno distintivo dell'Alzheimer e delle malattie simili.
Tenere lontano i mostri
La formazione infinita di placche amiloidi è come una scuola di danza dove va tutto storto. Immaginiamo una cellula al "ballo di fine anno": nella maggior parte dei casi, le molecole proteiche girano, volteggiano con passi specifici. Le cellule hanno anche proteine speciali chiamate chaperoni (=accompagnatori, ciceroni) che cercano di mantenere l'ordine.
I chaperoni hanno vari ruoli per aiutare le proteine a piegarsi ed a mantenere la loro forma normale. Un grande complesso chaperone, per esempio, può circondare completamente una proteina che si sta svolgendo, proteggerla da altre proteine che potrebbero attaccarsi ad essa, e aiutarla a ripiegarsi correttamente.
Tutto va bene nel ballo molecolare finchè non si presenta una proteina amiloide macabra. Gli scienziati hanno visto che anche una sola molecola di queste proteine può indurre copie sane della stessa proteina a piegarsi male e a produrre placche collose. Le proteine mal ripiegate possono diffondersi per ingestione e anche per trasfusioni di sangue. Tali proteine infettive, chiamate prioni, portano alla malattia di Creutzfeldt-Jakob e all'encefalopatia spongiforme bovina (nota anche come malattia della "mucca pazza").
Troppe proteine amiloidi possono sopraffare i chaperoni, provocando la formazione di placche soverchiando le attività di protezione. Ulteriori ricerche possono rivelare come allontanare questo incubo, aiutando potenzialmente le persone che hanno o possono sviluppare malattie legate agli amiloidi. Alcune possibilità studiate al momento comprendono l'utilizzo di farmaci che inducono le proteine a rischio a piegarsi correttamente o ad aumentare la potenza o il numero di molecole chaperone della cellula.
Fonte: NIH, National Institute of General Medical Sciences (NIGMS), via Newswise.
Pubblicato in newswise.com (> English version) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |










 Associazione Alzheimer OdV
Associazione Alzheimer OdV