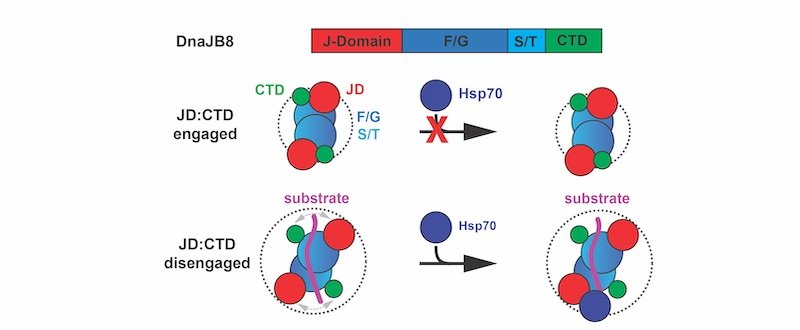
 Nello stato nativo, il chaperone DnaJB8 forma oligomeri solubili in cui il dominio J (JD, rosso) è impegnato in interazioni elettrostatiche con il dominio C-terminale (CTD, verde) e quindi non è disponibile per legare l'Hsp70 (blu). Gli autori dello studio propongono che il legame del substrato (viola) può interrompere l'interazione JD-CTD, esponendo il JD e consentendo il reclutamento di Hsp70 alla proteina DnaJB8 attivata dal substrato.
Nello stato nativo, il chaperone DnaJB8 forma oligomeri solubili in cui il dominio J (JD, rosso) è impegnato in interazioni elettrostatiche con il dominio C-terminale (CTD, verde) e quindi non è disponibile per legare l'Hsp70 (blu). Gli autori dello studio propongono che il legame del substrato (viola) può interrompere l'interazione JD-CTD, esponendo il JD e consentendo il reclutamento di Hsp70 alla proteina DnaJB8 attivata dal substrato.
Uno studio guidato da ricercatori della University of Texas Southwestern ha identificato un meccanismo che controlla l'attività delle proteine chiamate chaperoni (guide, accompagnatori), che guidano le proteine a piegarsi nelle forme giuste.
I risultati, pubblicati online su Nature Communications, potrebbero far luce su centinaia di malattie degenerative e neurodegenerative causate da una proteina mal ripiegata, come l'Alzheimer, il Parkinson e l'Huntington, portando potenzialmente a nuovi trattamenti per queste condizioni devastanti.
Ogni proteina del corpo è prodotta in origine in una catena lineare, con i blocchi di costruzione aminoacidi allineati uno dopo l'altro. Ma, spiega l'autore senior Lukasz Joachimiak PhD, assistente professore nel Center for Alzheimer’s and Neurodegenerative Diseases della UT Southwestern, per assumere i loro ruoli nelle cellule, queste catene devono piegarsi in forme precise. I chaperoni aiutano le proteine a realizzare questo obiettivo proteggendo le loro porzioni vulnerabili mentre [le proteine] si portano in posizione e le guidano ad adottare la forma corretta.
Ogni cellula ha vari chaperoni che riconoscono e agiscono sui singoli tipi di proteine. Tuttavia, ogni chaperone non è attivo tutto il tempo, dice Joachimiak. Dei meccanismi di regolazione sconosciuti sembrano controllare quando determinati chaperoni entrano in gioco per guidare le rispettive proteine a piegarsi e quando si mettono da parte.
Joachimiak, che è anche membro del Peter O'Donnell Jr. Brain Institute, e i suoi colleghi, hanno studiato una famiglia di chaperoni chiamati Hsp40 che lavorano in combinazione con altri chaperoni chiamati Hsp70. I membri di questi co-chaperoni sono coinvolti nella piegatura corretta di molte proteine, compresa la Tau, che ha un ruolo chiave nel causare il morbo di Alzheimer, quando è mal ripiegata.
I chaperoni Hsp40 si legano ai Hsp70 attraverso una porzione specifica sull'Hsp40 chiamata 'dominio J'. Ma non sapevamo ancora come gli Hsp40 recidono questo legame quando non è più necessario. Per aiutare a rispondere a questa domanda, Joachimiak e i suoi colleghi hanno usato uno Hsp40 specifico chiamato DnaJB8 come modello.
Quando i ricercatori hanno modificato geneticamente queste proteine per far splendere di verde l'interno delle cellule, hanno scoperto che non esistevano solo come unità individuali, liberamente fluttuanti; i chaperoni DnaJB8 tendevano a formare aggregati, suggerendo che avevano dovuto attaccarsi l'un l'altro in qualche modo. Mantenevano questa capacità di aggregarsi quando erano isolati nei piatti di Petri.
Usando la modellazione al computer e guidati da esperimenti biochimici, i ricercatori hanno scoperto che due parti separate di questo chaperone erano attratte l'una all'altra attraverso un tipo di chimica chiamata 'interazione elettrostatica': parte del dominio J era attirato in una parte diversa di questa proteina chiamata 'dominio C-terminale' tramite interazioni caricate. La modellazione ha anche dimostrato che il dominio J e il dominio C-terminale si attaccavano insieme anche sulle singole molecole.
Joachimiak e il suo team hanno convalidato questi risultati sulle proteine DnaJB8 reali usando una tecnica chiamata 'risonanza magnetica nucleare a stato solido'. Hanno anche mostrato che i domini J e C-terminale si attaccavano l'un l'altro quando erano isolati dalla molecola DnaJB8 completa.
I ricercatori hanno sospettato che l'interazione tra questi due domini possa impedire al DnaJB8 di legarsi al suo co-chaperone, un Hsp70, impedendo loro di fare congiuntamente il lavoro di guida alla piegatura delle proteine. È certo che gli esperimenti hanno dimostrato che il dominio C-terminale del DnaJB8 era in competizione con un Hsp70 chiamato HspA1A, quando era aggiunto al DnaJB8 in provetta, impedendo all'HspA1A di legarsi al dominio J quando invece era vincolato il dominio C-terminale.
Joachimiak rileva che qualcosa può andare storto in questo o in altri meccanismi normativi che controllano l'attività dei chaperoni nelle malattie da proteine mal ripiegate. Trovare i modi per controllare questa attività attraverso farmaci o altri mezzi potrebbe essere un modo nuovo di trattare queste condizioni, attaccando il problema alla fonte.
"Potremmo sfruttare questo meccanismo per puntare direttamente questi chaperoni, attivandoli su richiesta", afferma Joachimiak, che è anche assistente professore di biochimica e docente di ricerca medica. "I nostri risultati potrebbero avere un impatto su centinaia di malattie in cui le proteine, ripiegandosi male, diventano cattive giocatrici".
Fonte: University of Texas Southwestern (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Bryan Ryder, Irina Matlahov, Sofia Bali, Jaime Vaquer-Alicea, Patrick van der Wel, Lukasz Joachimiak. Regulatory inter-domain interactions influenceHsp70 recruitment to the DnaJB8 chaperone. Nature Communications, 2021, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV