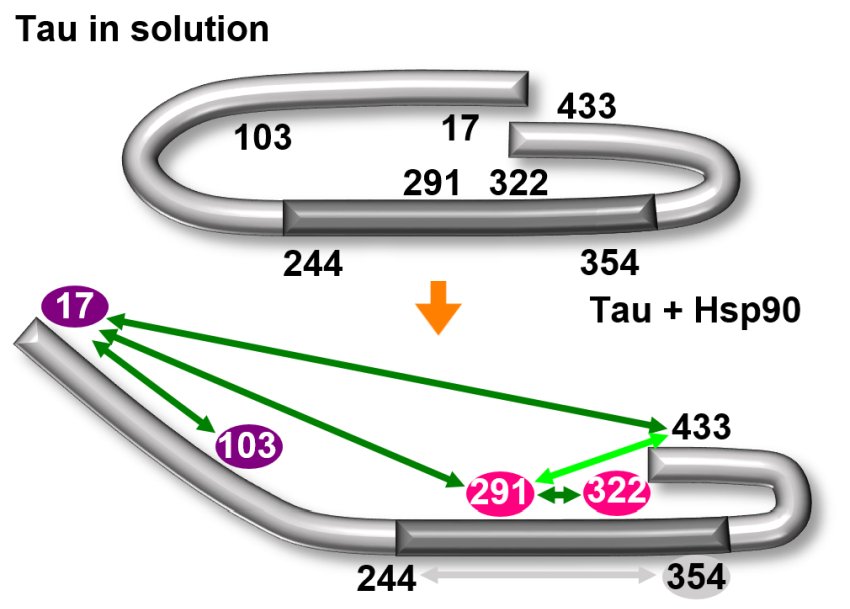
 Il chaperone HSP-90 apre la caratteristica conformazione a graffetta (sopra) della proteina tau. La regione centrale della molecola diventa quindi esposta (sotto) e prona all'aggregazione. Fonte: Università di Costanza
Il chaperone HSP-90 apre la caratteristica conformazione a graffetta (sopra) della proteina tau. La regione centrale della molecola diventa quindi esposta (sotto) e prona all'aggregazione. Fonte: Università di Costanza
Una delle caratteristiche del MA sono i grovigli neurofibrillari: depositi di proteina tau, che si accumulano nelle cellule nervose in forma di fibre e compromettono la comunicazione tra le cellule nervose.
Ma come si formano queste fibrille? Perché tali depositi nocivi si sviluppano dalla proteina tau originariamente utile, che di norma stabilizza le cellule? La questione è stata affrontata da un team di ricercatori dell'Università di Costanza e dell'Università di Utrecht (Paesi Bassi), guidato dal prof. Malte Drescher chimico dell'Unversità di Costanza.
Usando analisi strutturali, i ricercatori hanno portato alla luce un meccanismo biochimico sorprendente, in cui un chaperone molecolare (una proteina di guida, un cicerone) ha un ruolo insolito.
Diversamente da altre proteine, la tau non ha una struttura ben definita: è una “proteina intrinsecamente disordinata” che può assumere molte forme. “Possiamo immaginarla come una corda: a volte può essere allungata, a volte piegata, a volte ad anello”, spiega Malte Drescher. Nonostante tutta la varianza, la tau tende ad assumere una struttura tipicamente ricurva, paragonabile alla forma di una graffetta.
Un chaperone molecolare insolito
Non appena il chaperone HSP-90 (Heat Shock Protein 90) incontra la tau, avviene una cosa particolare: “Normalmente, è compito dei chaperoni portare alla forma corretta le proteine appena prodotte. Così essi esercitano una funzione di supporto per sviluppare la struttura delle proteine. Ci chiedevamo: quale potrebbe essere il loro compito di supporto in una proteina intrinsecamente disordinata come la tau?" riassume Drescher.
Con analisi strutturali, Drescher e il suo team sono riusciti a dimostrare che il chaperone provoca l'apertura della conformazione a graffetta della tau: piega verso l'esterno le 'braccia” della graffetta.
“L'area al centro della graffetta è pertanto esposta e diventa accessibile. Questa zona è nota per essere responsabile dell'aggregazione, vale a dire del suo attaccamento ad altre proteine tau“, spiega la biofisica Sabrina Weickert, prima autrice dello studio e ricercatrice sotto la supervisione di Malte Drescher. Nella loro forma dispiegata, le molecole tau possono quindi essere impilate una sopra l'altra con un incastro perfetto (oligomerizzazione).
“Questa oligomerizzazione da parte dell'HSP-90 è stata una grande sorpresa”, spiega Malte Drescher: “Un chaperone in realtà è responsabile esattamente del contrario: guidare una proteina a prendere una forma definita e in nessun caso contribuire alla formazione di una «pila di proteine»“.
Responsabile del MA o un meccanismo segreto di difesa?
La presenza del chaperone è quindi un pre-requisito per la formazione di fibrille di MA? Il chaperone, tra tutte le molecole, è in ultima analisi quello che provoca lo sviluppo del MA? I ricercatori studieranno queste domande in ulteriori studi.
Tuttavia, Malte Drescher sospetta esattamente l'opposto: “Direi esattamente il contrario: potrebbe anche essere un trucco del corpo per prevenire il MA”. Gli oligomeri tau prodotti dall'HSP-90 hanno una particolarità fondamentale: non continuano a crescere per formare le tipiche fibrille di MA pronunciate.
“L'oligomerizzazione provocata dall'HSP-90 potrebbe forse essere un meccanismo di difesa in cui il chaperone forza le proteine tau ad assumere la forma di piccoli strati oligomeri. Anche se questo non dà benefici, previene efficacemente la formazione di fibrille più lunghe, quelle del MA“, suggerisce Drescher.
Se questa ipotesi si rivelerà esatta, il chaperone avrebbe adempiuto il suo scopo dichiarato, che in questo caso è impedire lo sviluppo di fibrille lunghe di MA, facendo una mossa e legando la tau in pile più piccole e meno pericolose.
'Spin labels'
La proteina tau è grande solo pochi nanometri (miliardesimi di metro), e non è visibile ad occhio nudo o con microscopi leggeri. Gli esperimenti tipici, come l'analisi a raggi X, non riescono a determinarne la struttura, perché la tau come proteina intrinsecamente disordinata è estremamente flessibile.
Per determinare comunque i cambiamenti strutturali della proteina, i ricercatori hanno allora fatto ricorso a un metodo sofisticato: hanno attaccato piccole molecole sonda, 'spin labels', a posizioni chiave della molecola, comprese le 'braccia' esterne della conformazione a graffetta. “Le sonde sono magnetiche e si rilevano reciprocamente. Misurando l'interazione tra le sonde possiamo quindi determinare la distanza tra le loro posizioni“, spiega Malte Drescher. In questo modo, si possono rilevare indirettamente sia la conformazione della molecola che le sue modifiche strutturali.
La serie di esperimenti ha avuto luogo in vitro, con tau purificata e molecole HSP-90 in provetta. “Ora vogliamo portare l'esperienza dentro la cellula per osservare il meccanismo biochimico nelle condizioni del mondo reale all'interno di una cellula”, spiega Malte Drescher, dando uno sguardo alla ricerca futura. L'obiettivo a lungo termine è comprendere meglio lo sviluppo del MA e trovare metodi per prevenirlo.
Fonte: University of Konstanz (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Sabrina Weickert, Magdalena Wawrzyniuk, Laura John, Stefan G. D. Rüdiger, Malte Drescher. The molecular mechanism of Hsp90-induced oligomerization of Tau. Biorxiv, Mar 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.





 Associazione Alzheimer OdV
Associazione Alzheimer OdV