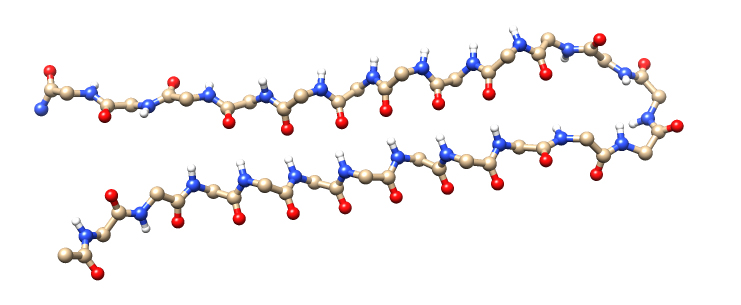
 Modello a sfere e bastoncini della struttura di AP407, uno dei peptidi sintetici di foglio alfa progettati per inibire gli oligomeri tossici dell'amiloide-beta (Fonte: Shea et al.)
Modello a sfere e bastoncini della struttura di AP407, uno dei peptidi sintetici di foglio alfa progettati per inibire gli oligomeri tossici dell'amiloide-beta (Fonte: Shea et al.)
L'Alzheimer è una malattia di aggregazione. I neuroni nel cervello umano producono una proteina chiamata amiloide-beta. Tali proteine, in sé stesse (chiamate monomeri di amiloide-beta), svolgono compiti importanti per i neuroni.
Ma nel cervello delle persone con morbo di Alzheimer (MA), i monomeri amiloide-beta hanno abbandonato il loro lavoro e si sono raggruppati. All'inizio formano oligomeri - piccoli gruppi di circa una dozzina di proteine - e poi trecce più lunghe e infine grandi depositi chiamati placche.
Per anni, gli scienziati hanno creduto che fossero le placche ad attivare i disturbi cognitivi caratteristici del MA. Ma nuove ricerche implicano gli aggregati più piccoli di amiloide-beta come elementi tossici di questa malattia.
Ora, un team guidato da ricercatori dell'Università di Washington ha sviluppato peptidi sintetici che puntano e inibiscono quei piccoli aggregati tossici. Come riportano in un articolo pubblicato la settimana del 15 aprile su Proceedings of the National Academy of Sciences, i loro peptidi sintetici - che sono progettati per piegarsi in una struttura chiamata 'foglio alfa' - possono bloccare l'aggregazione iniziale dell'amiloide-beta e la maggior parte della fase tossica quando si formano gli oligomeri.
Il team ha dimostrato che l'attività di blocco del foglio alfa sintetico ha ridotto la tossicità innescata dall'amiloide-beta in cellule neuronali umane in coltura e ha inibito gli oligomeri di amiloide-beta in due animali modelli di laboratorio del MA. Questi risultati si aggiungono alle evidenze crescenti che gli oligomeri amiloide-beta, non le placche, sono gli agenti tossici dietro il MA.
I risultati indicano anche che i fogli alfa sintetici potrebbero costituire la base delle terapie per eliminare gli oligomeri tossici nelle persone, secondo l'autrice senior Valerie Daggett, professoressa di bioingegneria alla UW: "Si tratta di puntare una struttura specifica di amiloide-beta formata dagli oligomeri tossici. Quello che abbiamo mostrato qui è che possiamo progettare e costruire fogli alfa sintetici con strutture complementari per inibire l'aggregazione e la tossicità dell'amiloide-beta, lasciando intatti i monomeri biologicamente attivi".
Le proteine cellulari assumono molte strutture 3D diverse e di solito si piegano prima in alcuni tipi di forme base. Il foglio alfa è una struttura proteica non standard, scoperta dal gruppo della Daggett usando simulazioni computazionali. Il team di ricerca aveva dimostrato in precedenza che i fogli alfa sono associati all'aggregazione dell'amiloide-beta.
Questi, e i risultati relativi, indicano che, in natura, i fogli alfa probabilmente sono presenti solo nei rari casi in cui le proteine si piegano in modo errato e interagiscono in modi che interrompono la funzione cellulare, portando a malattie cosiddette da 'proteine mal ripiegate' come il MA.
In questo nuovo documento, la Daggett e il suo team dimostrano che gli oligomeri di amiloide-beta formano una struttura a foglio alfa mentre si aggregano in trecce e placche più lunghe. Criticamente, i fogli alfa sintetici del team possono effettivamente bloccare questa aggregazione legando e neutralizzando specificamente gli oligomeri tossici.
Utilizzando tecniche spettroscopiche sia nuove che convenzionali, il team della Daggett ha osservato le singole fasi di sviluppo dei gruppi di amiloide-beta, dai monomeri agli oligomeri a sei e 12 proteine fino alle placche, nelle linee cellulari neurali umane. I ricercatori hanno confermato che gli stadi di oligomero erano più tossici per i neuroni, il che concorda con le segnalazioni cliniche di placche di amiloide-beta nel cervello di persone che non hanno il MA.
"L'amiloide-beta ha sicuramente un ruolo di primo piano nel MA, ma mentre storicamente l'attenzione è stata posta sulle placche, sempre più ricerche indicano invece che gli oligomeri di amiloide-beta sono gli agenti tossici che distruggono i neuroni", ha detto la Daggett.
In più, i ricercatori hanno progettato e costruito piccoli peptidi di fogli alfa sintetici, ciascuno composto da soli 23 aminoacidi, i mattoni delle proteine. I peptidi sintetici si ripiegano in una struttura a forcina e non sono tossici per le cellule. Ma i fogli alfa sintetici hanno neutralizzato gli oligomeri di amiloide-beta nelle colture di cellule neurali umane, inibendo l'ulteriore aggregazione attraverso il blocco di parte degli oligomeri coinvolti nella formazione di gruppi più grandi.
I peptidi hanno protetto anche gli animali da laboratorio dai danni degli oligomeri tossici. Nei campioni di tessuto cerebrale prelevati da topi, il gruppo ha osservato un calo fino all'82% dei livelli di oligomeri amiloide-beta dopo il trattamento con un peptide di foglio alfa sintetico. La somministrazione di un foglio alfa sintetico sui topi viventi ha provocato un calo del 40% dei livelli di oligomero amiloide-beta dopo 24 ore.
Nel comune verme da laboratorio Caenorhabditis elegans, un altro modello di MA, il trattamento con fogli di alfa sintetici ha ritardato l'insorgenza della paralisi indotta dall'amiloide-beta. Inoltre, i vermi C. elegans mostrano segni di danno intestinale quando sono nutriti con batteri che esprimono amiloide-beta. Questo danno è stato inibito quando gli scienziati hanno prima trattato i batteri con i loro fogli alfa sintetici.
Il team della Daggett sta continuando gli esperimenti con fogli alfa sintetici per progettare composti che sono ancora più efficaci nell'eliminare gli oligomeri di amiloide-beta. Per il presente studio, i ricercatori hanno anche creato un nuovo test di laboratorio che usa un foglio alfa sintetico per misurare i livelli di oligomeri di amiloide-beta.
Ritengono che questa analisi potrebbe costituire la base di un test clinico per rilevare gli oligomeri tossici nelle persone prima dell'insorgere dei sintomi del MA: "Quello che stiamo cercando sono le potenziali terapie contro l'amiloide-beta e le misure diagnostiche per rilevare gli oligomeri tossici nelle persone", ha affermato la Daggett. "Questi sono i prossimi passi".
Fonte: University of Washington | Seattle (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: n/d
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.















 Associazione Alzheimer OdV
Associazione Alzheimer OdV