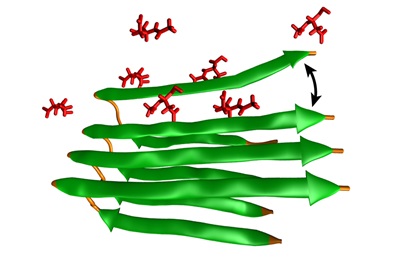
 Le molecole NAA (rosse) si inseriscono tra fogli di amiloide-beta (verdi) per prevenire o invertire la formazione di fibrille amiloidi (Fonte: University of Pennsylvania).La chiave per migliorare i trattamenti per le lesioni e le malattie cerebrali può essere nelle molecole incaricate di prevenire l'aggregazione di specifiche proteine associate al declino cognitivo e ad altri problemi neurologici, secondo quanto riferiscono dei ricercatori dell'Università della Pennsylvania in un nuovo studio pubblicato su Neurobiology of Disease.
Le molecole NAA (rosse) si inseriscono tra fogli di amiloide-beta (verdi) per prevenire o invertire la formazione di fibrille amiloidi (Fonte: University of Pennsylvania).La chiave per migliorare i trattamenti per le lesioni e le malattie cerebrali può essere nelle molecole incaricate di prevenire l'aggregazione di specifiche proteine associate al declino cognitivo e ad altri problemi neurologici, secondo quanto riferiscono dei ricercatori dell'Università della Pennsylvania in un nuovo studio pubblicato su Neurobiology of Disease.
Le concentrazioni di queste molecole cerebrali - chiamate N-acetilaspartato (NAA) - sono note per diminuire quando le persone soffrono di lesioni e malattie cerebrali. Mentre l'NAA è stato storicamente usato come marcatore di malattia, il suo ruolo principale nel cervello è rimasto un mistero.
Ora, i ricercatori di neuroscienze della Penn hanno dimostrato che l'NAA si frappone tra le pieghe delle fibrille di amiloide-beta per impedire loro di bloccarsi, piegarsi e aggregarsi, creando le placche amiloidi dannose.
"Per decenni, l'NAA è stato visto come un semplice segno di ferita, quando in realtà potrebbe essere una parte del processo di recupero", ha detto l'autore senior Douglas H. Smith MD, direttore del Centro Lesioni e Riparazioni Cerebrali e professore di Neurochirurgia nella Facoltà di Medicina Perelman della Penn. "Abbiamo scoperto che si tratta di un tipo di «anticongelante» del cervello che funziona per mettere in pausa e persino invertire l'aggregazione o il misfolding (=errata piegatura) delle proteine di amiloide-beta, che avviene dopo una lesione cerebrale. In questo modo, può proteggere il cervello".
L'NAA è uno degli amminoacidi più abbondanti nel cervello e con la più alta concentrazione nei neuroni. Dopo una lesione cerebrale traumatica (TBI), le scansioni con spettroscopia a risonanza magnetica protonica mostrano costantemente una riduzione di NAA del 20% circa nella sostanza bianca dei pazienti, notano gli autori. Questo è seguito dal rapido aggregarsi di proteine di amiloide-beta che formano placche di amiloide (presenti in un gran numero di pazienti con trauma cranico che muoiono poco dopo la lesione) simili alla patologia tipica del morbo di Alzheimer.
Nel corso degli anni sono state tentate diverse strategie per ridurre l'aggregazione dell'amiloide-beta, come l'immunoterapia e gli inibitori della beta-secretasi, ma nessuno di questi si è dimostrato clinicamente efficace. Questo nuovo studio suggerisce che il ripristino dell'NAA a livelli normali dopo il trauma cranico o nelle malattie neurologiche, come l'Alzheimer, potrebbe bloccare la progressione delle patologie amiloidi.
Usando campioni umani di amiloide-beta in laboratorio, il team ha dimostrato che le concentrazioni di NAA hanno compromesso sostanzialmente l'aggregazione di amiloide-beta. E' possibile che l'NAA crei delle "dorsali peptidiche", affermano gli autori: l'NAA si inserisce tra strati di grumi di amiloide-beta e protofibrille, impedendo la formazione di fibrille amiloidi mature.
I ricercatori hanno usato diverse tecniche per determinare il ruolo dell'NAA, compresa la fluorescenza del colorante Thioflavin T, che viene usata regolarmente per quantificare la formazione e l'inibizione degli amiloidi. La microscopia elettronica ha anche confermato l'assenza di fibrille mature dopo il trattamento con NAA. L'NAA potrebbe stabilizzare le fibrille più piccole e impedire l'ulteriore organizzazione in quelle allungate e più mature, hanno ipotizzato gli autori.
I ricercatori hanno anche dimostrato che l'aggiunta di NAA può persino invertire l'aggregazione. Dopo 25 minuti, la NAA aggiunta all'aggregato di amiloide-beta ha iniziato a rompere le fibrille amiloidi preformate. Questo lavoro può avere importanti implicazioni per il trattamento di TBI e disturbi neurodegenerativi.
"Mostriamo una nuova e potenzialmente significativa funzione biologica dell'NAA nel cervello, come agente sorprendentemente efficace per inibire e persino invertire l'aggregazione dell'amiloide-beta", ha detto il primo autore Jean-Pierre Dollé PhD, del Penn Center for Brain Injury and Repair. "Questo ci dice molto sulle lesioni cerebrali e sulla neurodegenerazione e ci indirizza verso possibili terapie per fermarlo. Questi risultati supportano l'inizio di una nuova linea di ricerca per rivelare i potenziali meccanismi di interazioni dell'NAA con l'amiloide-beta nei pazienti".
Fonte: University of Pennsylvania (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Jean-Pierre Dollé, Jeffrey M. Rodgers, Kevin D. Browne, Thomas Troxler, Feng Gai, Douglas H. Smith. Newfound effect of N -acetylaspartate in preventing and reversing aggregation of amyloid-beta in vitro. Neurobiology of Disease, 2018; 117: 161 DOI: 10.1016/j.nbd.2018.05.023
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.















 Associazione Alzheimer OdV
Associazione Alzheimer OdV