Se c'è una cosa che è chiarissima riguardo al morbo di Alzheimer (MA), è che corrode i neuroni e i collegamenti tra di loro, distruggendo infine le reti neurali che sono alla base dei nostri ricordi.
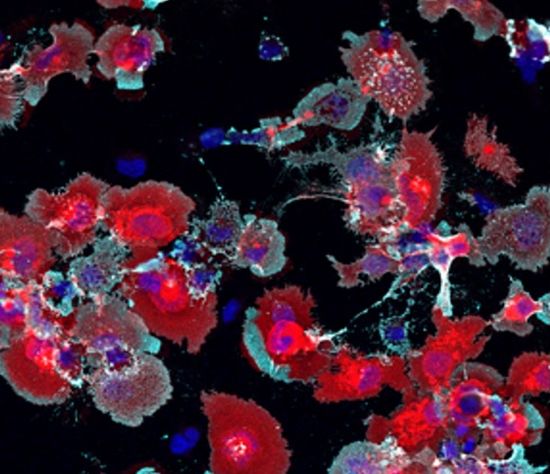 LilrB2 (rosso) e C4d (ciano) si legano tra loro nei test di laboratorio. (Fonte: Carla Shatz / Stanford University)
LilrB2 (rosso) e C4d (ciano) si legano tra loro nei test di laboratorio. (Fonte: Carla Shatz / Stanford University)
Il modo esatto in cui si sviluppa la malattia non è ancora chiaro. Secondo una teoria popolare, un frammento proteico chiamato amiloide-beta (Aβ) si accumula nel cervello e danneggia i neuroni. Ma ci sono una miriade di altre possibilità legate alle proteine tau, ai lisosomi, alla neuroinfiammazione, alle cellule immunitarie microglia e altro ancora.
Ora, dei ricercatori pensano di aver trovato un modo per unire due di queste teorie in una sola. In uno studio pubblicato su PNAS, il team aggiunge ulteriore prove che l’Aβ e l’infiammazione convergono su un unico punto: un recettore chimico che dice ai neuroni nel cervello quando rimuovere i collegamenti tra i neuroni, chiamati sinapsi.
Due linee di ricerca si combinavano nel nuovo studio, guidato dalla prof.ssa Carla Shatz, affiliata al Wu Tsai Neurosciences Institute, e da Barbara Brott, la prima autrice, ricercatrice nel laboratorio di Shatz:
- La prima linea di ricerca coinvolge una molecola recettore chiamata LilrB2, che Shatz conosce molto bene. Nel 2006, lei e i suoi colleghi hanno scoperto che l’equivalente di LilrB2 nei topi ha un ruolo chiave nella 'potatura' delle sinapsi, una parte normale dello sviluppo del cervello e dell’apprendimento degli adulti. Ma ci sono collegamenti anche con il MA: nel 2013, il team ha dimostrato che l’Aβ si lega allo stesso recettore e, quando lo fa, attiva i neuroni per potare le sinapsi. Inoltre, eliminando geneticamente il recettore si previene la perdita di memoria nei topi modello di MA.
- La seconda linea di ricerca riguarda un processo infiammatorio chiamato 'cascata del complemento'. Di solito, il processo produce una pioggia di molecole che aiutano a eliminare virus, batteri e cellule infette dal corpo. Ma l’infiammazione è un importante fattore di rischio per il MA e studi recenti hanno collegato la cascata del complemento in particolare alla potatura sinaptica e alle malattie neurologiche.
Ciò ha portato Shatz a chiedersi se la cascata del complemento, come l’Aβ, potrebbe attivare anche il recettore LilrB2, innescando la potatura sinaptica. Per scoprirlo, il team ha prima eseguito delle selezioni per vedere se qualche molecola della cascata del complemento si lega a quel recettore. Ne hanno trovato uno, e uno solo: C4d, che si legava abbastanza strettamente al recettore da far pensare al team che potesse contribuire alla perdita di sinapsi.
Per testare questa ipotesi, hanno pompato C4d direttamente nel cervello dei topi normali. "Guarda caso, ha strappato le sinapsi dai neuroni", ha detto la Shatz, una vera sorpresa per una molecola che i ricercatori avevano precedentemente pensato fosse senza alcuna funzione. Il risultato di tutto ciò è che l’Aβ e la neuroinfiammazione possono contribuire alla perdita di sinapsi attraverso un meccanismo comune, e ciò potrebbe richiedere una rivalutazione del modo in cui il MA distrugge la memoria.
"C'è un intero insieme di molecole e percorsi che portano dall'infiammazione alla perdita di sinapsi che potrebbero non aver ricevuto l'attenzione che meritano", ha detto la Shatz, che è anche prof.ssa di biologia alla Facoltà di Lettere e Scienze e di neurobiologia alla Facoltà di Medicina.
I risultati mettono anche in discussione l'opinione condivisa da molti nel campo secondo cui le glia, le cellule immunitarie del cervello, sono le principali responsabili della perdita di sinapsi nel MA. "I neuroni non sono spettatori innocenti", ha detto la Shatz, “sono partecipanti attivi”.
E, ha detto Shatz, tale osservazione potrebbe avere un impatto diretto sul trattamento. Al momento, gli unici farmaci approvati dalla FDA per il trattamento del MA tentano di rompere le placche amiloidi nel cervello. Ma "la distruzione delle placche amiloidi non funziona così bene, e ci sono molti effetti collaterali", come mal di testa ed emorragie cerebrali, ha detto Shatz. "E anche se funzionassero bene, risolveresti solo una parte del problema".
La soluzione migliore potrebbe essere quella di puntare i recettori come LilrB2 che sono direttamente responsabili della perdita di sinapsi e, proteggendo le sinapsi, secondo la Shatz, possiamo proteggere anche la memoria.
Fonte: Stanford University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: BK Brott, [+6], CJ Shatz. C4d, a high-affinity LilrB2 ligand, is elevated in Alzheimer’s disease and mediates synapse pruning. PNAS, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.












 Associazione Alzheimer OdV
Associazione Alzheimer OdV