Dominika Pilat PhD e Ana Griciuc PhD, del Dipartimento di Neurologia del Massachusetts General Hospital, sono le autrici (rispettivamente prima e senior) di uno studio pubblicato su Neuron.
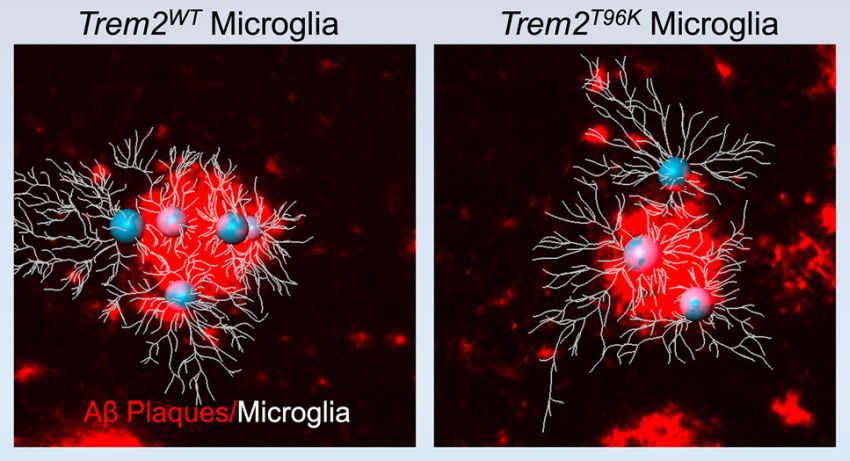 Rappresentazione grafica dell'azione della mutazione T96K del gene Trem2 nelle microglia (Fonte: Pilat et al / Neuron)
Rappresentazione grafica dell'azione della mutazione T96K del gene Trem2 nelle microglia (Fonte: Pilat et al / Neuron)
D: Come riassumereste il vostro studio per un pubblico profano?
Il nostro team voleva capire come le cellule immunitarie del cervello, chiamate microglia, contribuiscono alla patologia del morbo di Alzheimer (MA). È noto che sottili cambiamenti, o mutazioni, nei geni espressi nelle microglia sono associati ad un aumento del rischio di sviluppare il MA a esordio tardivo.
Il nostro studio si è concentrato su una delle mutazioni nel gene microgliale TREM2, un interruttore essenziale che induce le microglia a ripulire le placche amiloidi tossiche (depositi proteici anomali) che si accumulano tra le cellule nervose nel cervello. Questa mutazione, chiamata T96K, è una mutazione a 'guadagno di funzione' in TREM2, il che significa che aumenta l’attivazione di TREM2 e consente al gene di rimanere super attivo.
Con la nostra ricerca, abbiamo esplorato come questa mutazione influisce sulla funzione microgliale aumentando il rischio di MA. Abbiamo generato un modello di topo mutante, portatore della mutazione, che è stato incrociato con topi modello di MA perché avesse cambiamenti cerebrali coerenti con il MA. Abbiamo scoperto che, esclusivamente nei topi femmina con MA, la mutazione riduceva fortemente la capacità delle microglia di rispondere alle placche amiloidi tossiche, riducendo la protezione di queste cellule dall’invecchiamento cerebrale.
D: Su quale domanda stavate indagando?
Ci siamo chiesti se la mutazione T96K nel gene TREM2 aiuta o danneggia la patogenesi del MA. Il che ci ha portato a studiare come questa mutazione influisce sulla funzione microgliale nei topi modello di MA.
D: Quali metodi o approcci avete impiegato?
Per analizzare il ruolo di questa mutazione nel MA, abbiamo combinato studi su geni umani, sul nuovo modello di topi TREM2-T96K e test di laboratorio su cellule microgliali. Per esaminare il tessuto cerebrale, abbiamo usato una tecnica di scansione ottica chiamata microscopia confocale e strumenti di tracciamento delle proteine, incluso l’ELISA. Infine, abbiamo usato il sequenziamento dell’RNA di cellule microgliali isolate dal cervello di topo e l’analisi bioinformatica per mappare esattamente come la mutazione T96K modifica l’attività delle microglia nel tempo.
D: Cosa avete scoperto?
Il nostro studio è il primo a dimostrare che una mutazione con guadagno di funzione in TREM2 (non solo quella con perdita di funzione) è associata al rischio di MA e che compromette l'assorbimento dell'amiloide- beta (Aβ) tossica. Inoltre, la mutazione specifica T96K su cui ci siamo concentrati ha ridotto l’area totale coperta dalle 'squadre di pulizia' formate da microglia e ha soppresso la loro risposta di lotta contro la malattia, in particolare nei topi femmina con MA.
D: Quali sono le implicazioni?
Il nostro studio sulle mutazioni con guadagno di funzione di TREM2 cambia la comprensione della funzione di TREM2, non solo dal punto di vista genetico, ma anche da quello terapeutico. Questi risultati dovrebbero aiutare a guidare nuovi approcci terapeutici per prevenire e trattare il MA, basati su TREM2 come obiettivo. In particolare, i nostri risultati sottolineano anche la necessità di ulteriori studi che chiariscano se nuove terapie per il MA che puntano a migliorare l’attività di TREM2 potrebbero avere effetti negativi, anziché benefici, sulla patogenesi del MA.
D: Quali sono i prossimi passi?
Il lavoro futuro si concentrerà sullo studio del ruolo delle mutazioni con guadagno di funzione di TREM2 nel modulare le funzioni immunitarie, il metabolismo dei lipidi microgliali e l'invecchiamento cellulare nelle cellule simili alle microglia umane e nei topi modello di MA.
Fonte: Mass General Brigham (> English) - Traduzione di Franco Pellizzari.
Riferimenti: DJ Pilat, [+12], A Griciuc. The Gain-of-Function TREM2-T96K Mutation Increases Risk for Alzheimer’s Disease by Impairing Microglial Function. Neuron, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.










 Associazione Alzheimer OdV
Associazione Alzheimer OdV