Il concetto di riserva rappresenta le differenze individuali nella suscettibilità ai cambiamenti cerebrali legati all'età o alla patologia correlata all'Alzheimer. Ci sono prove che alcune persone possono tollerare una quantità maggiore di questi cambiamenti rispetto ad altri e comunque mantenere la funzionalità.
Studi epidemiologici suggeriscono che le esperienze di tutta la vita, che comprendono le conquiste dell'istruzione e quelle professionali, e le attività ricreative dell'anzianità, possono aumentare questa riserva. Ad esempio c'è una riduzione del rischio di sviluppare l'Alzheimer per i soggetti con una maggiore realizzazione professionale o scolastica.
Conviene pensare a due tipi di riserva:
- Cerebrale, che si riferisce alle differenze reali nel cervello stesso che possono aumentare la tolleranza alla patologia;
- Cognitiva, che si riferisce alle differenze individuali nel modo in cui vengono eseguiti i compiti che possono consentire ad alcune persone di essere più resistenti di altre; il concetto di riserva cognitiva contiene la promessa di interventi che potrebbero rallentare l'invecchiamento cognitivo o ridurre il rischio di demenza.
Si discute da lungo tempo sulla possibilità di una connessione tra esperienze di vita e prevalenza di demenza. Nel 1981 Gurland (1) ha scritto: "E' ancora una questione aperta che ci sia un importante contributo socio-culturale alla prevalenza dell'Alzheimer e ad altre forme di demenza che insorgono nel senium, ma le prove disponibili sono sufficientemente intriganti da giustificare ulteriori studi sulla questione".
In un interessante abbinamento di articoli del 1986, Kittner (2) ha suggerito di correggere per l'istruzione, quando si esamina la demenza, per evitare distorsioni nell'accertamento. In una visione discordante, Berkman (3) ha suggerito che dobbiamo rimanere aperti a considerare che "il livello di istruzione e/o i comportamenti socio-economici correlati ad esso possono essere fattori di rischio reale per la demenza senile e sono degni di esplorazione scientifica per le loro conseguenze".
Nel 1990, Katzman e colleghi hanno pubblicato un rapporto secondo il quale una minore istruzione è associata ad una maggiore prevalenza dell'Alzheimer e della demenza a Shanghai in Cina (4). Queste osservazioni hanno suscitato il mio interesse per lo studio dell'associazione tra i vari aspetti delle esperienze di vita e la demenza e, successivamente, un programma di ricerca a lungo termine progettato per comprendere la riserva cognitiva (CR).
Questa recensione fornisce un resoconto teorico della riserva e riassume la ricerca epidemiologica che ha dato supporto al concetto di riserva cognitiva. Descrive i nostri tentativi di identificare i substrati neurali della riserva, utilizzando studi di imaging. Infine, esaminerà le implicazioni cliniche del concetto di CR. Anche se rivedo la CR nel contesto dell'Alzheimer e dell'invecchiamento normale, è stato dimostrato anche che dà benefici alle lesioni vascolari (5)–(7), al Parkinson (8), alle lesioni cerebrali traumatiche (9), all'HIV (10), ai disturbi neuropsichiatrici (11) {Wykes 2011 # 8097} e alla sclerosi multipla (12).
Riserva cognitiva e Cerebrale
Il concetto di riserva è stato introdotto per tenere conto delle differenze individuali nella suscettibilità ai cambiamenti del cervello legati all'età e ai cambiamenti patologici, come quelli che avvengono nell'Alzheimer. La riserva può fungere da moderatore tra la patologia e l'esito clinico, rappresentando così questa discontinuità. Una classificazione differenziale comoda, anche se un po' artificiale, della riserva è: cerebrale contro cognitiva.
Il concetto originale di riserva cerebrale era quantitativa, ad esempio più neuroni o sinapsi da perdere. Questa idea è supportata da una serie di studi che suggeriscono che la prevalenza o l'incidenza della demenza è minore nei soggetti con cervello più grande (13), (14). Ho suggerito che questo è un modello passivo di riserva, in quanto postula che il cervello può tollerare semplicemente più patologia prima che raggiunga una soglia critica in cui appaiono i sintomi clinici.
Al contrario, il concetto di CR suggerisce che il cervello tenta attivamente di far fronte ai danni cerebrali usando approcci preesistenti di elaborazione cognitiva o arruolando approcci compensativi (15), (16). Questo permetterebbe a un individuo con CR alta di affrontare meglio il danno cerebrale rispetto a un individuo con CR più bassa. Nella CR, è la funzione del cervello la variabile rilevante, piuttosto che le dimensioni del cervello. Così il concetto di CR è una forma attiva di riserva nella quale la stessa quantità di danni cerebrali o patologia hanno effetti diversi su persone diverse, anche a parità di dimensione del cervello.
Anche se la concezione iniziale di riserva cerebrale era completamente quantitativa, recenti evidenze suggeriscono che questo concetto è più sfumato. Per esempio ambienti stimolanti favoriscono la crescita di nuovi neuroni in forma di neurogenesi (17)–(19) e sovra-regolano il BDNF (20), che favorisce la plasticità neurale. Eppure, anche se sono in qualche modo interdipendenti, riserva cerebrale e CR sono indipendenti, oltre ai contributi sinergici per capire le differenze individuali nella capacità di resilienza clinica alla patologia cerebrale. E' ancora una questione irrisolta se e come interagiscono queste due componenti della riserva.
La riserva è stata inizialmente considerata come moderatrice tra cambiamento del cervello ed esito clinico, ma ci sono suggerimenti recenti che anche l'esperienza di vita può agire per prevenire o ridurre al minimo la patologia. A un livello semplice, si è sempre riconosciuto che l'esercizio fisico può aiutare a prevenire le malattie vascolari. Tuttavia, ci sono suggerimenti che le attività cognitivamente stimolanti possono rallentare il tasso di atrofia ippocampale nel normale invecchiamento (21), e forse anche prevenire l'accumulo di placche amiloidi (22). Anche se queste idee sono promettenti e intriganti, sono oltre lo scopo di questa revisione, che sarà limitata a quanto può aiutare la CR a far fronte ai cambiamenti del cervello una volta che si sviluppano.
Evidenze epidemiologiche della riserva
Il nostro gruppo ha affrontato per primo il concetto di CR in uno studio sulla demenza. L'ipotesi è che la patologia della malattia si sviluppi lentamente nel tempo, indipendentemente dalla CR, e che la patologia inizi molti anni prima della comparsa della diagnosi clinica di AD. Dal momento che le persone con una maggiore riserva dovrebbero essere in grado di tollerare più patologia di AD, dovrebbe essere ritardata l'insorgenza della demenza clinica.
Abbiamo analizzato i dati di 593 soggetti non affetti da demenza over-60 seguiti per oltre 4 anni (23). Gli individui con meno di 8 anni di istruzione avevano un rischio di sviluppare demenza 2,2 volte più elevato rispetto a quelli con più istruzione. Abbiamo anche esaminato il potenziale impatto della realizzazione professionale. Sulla base delle categorie del censimento USA, i partecipanti sono stati raggruppati in livello occupazionale basso (non qualificato / semi-qualificato, commerciante o artigiano specializzato, e impiegato generico) e alto (dirigente affari/governativo e professionale/tecnico).
Anche quelli di bassa realizzazione professionale di tutta la vita avevano un rischio di sviluppare la demenza 2,25 volte maggiore rispetto a quelli con una maggiore realizzazione professionale nella vita. Questi risultati implicano che le esperienze formative e professionali conferiscono una riserva contro l'espressione della patologia di Alzheimer.
In uno studio successivo, abbiamo valutato la partecipazione ad una serie di attività per il tempo libero in un altro gruppo di individui senza demenza (24). Un'intervista ha generato un rapporto auto-riferito sulla partecipazione nel mese precedente alle seguenti 13 attività: lavoro a maglia o musica o altro hobby, cammino per piacere o escursione, visita amici o parenti, essere visitati da parenti o amici, condizionamento fisico, andare al cinema o ristoranti o eventi sportivi, lettura di riviste o giornali o libri, guardare la televisione o ascoltare la radio, lavoro volontario non retribuito nella comunità, carte o giochi o bingo, andare in un club o un centro, partecipazione a corsi, e andare in chiesa o sinagoga o tempio.
Abbiamo diviso i partecipanti in partecipazione bassa (<=6) o alta (>6) alle attività del tempo libero. Coloro che si erano impegnati in più attività di svago hanno avuto il 38% in meno di rischio di sviluppare demenza. Una revisione (25) ha trovato 22 ricerche che riportano studi di coorte sugli effetti di istruzione, occupazione, IQ premorbosa e attività mentali sulla demenza incidente, pubblicati fino al 2004. La grande maggioranza degli studi hanno dimostrato un effetto protettivo significativo di tali esperienze della vita. Gli autori hanno riassunto tutti gli studi per calcolare l'effetto protettivo di una CR più alta e hanno scoperto che ha diminuito il rischio di sviluppare demenza del 46%.
Al contrario, una volta che l'AD è emersa, quelli con riserva superiore mostrano un declino più rapido. In uno dei primi studi di questo tipo, abbiamo confrontato i pazienti con AD per gravità clinica e poi li abbiamo seguiti nel tempo (26). Quelli con maggiore istruzione o realizzazione professionale sono morti prima di quelli con meno conseguimento. In una successiva analisi, abbiamo anche scoperto che quelli con un livello più alto di istruzione o di lavoro (come definito sopra) avevano un declino cognitivo più rapido (27). In media il punteggio dei test di memoria declina di circa un punto ogni anno, ma in quelli con migliore riuscita scolastica o professionale i punteggi diminuiscono di un ulteriore punto ogni anno. Abbiamo replicato questa osservazione in pazienti con AD incidente (28) e anche qui abbiamo trovato un declino più rapido della funzione cognitiva nei pazienti con AD che si erano impegnati in più attività del tempo libero prima dell'insorgenza della demenza (29).
La nostra spiegazione teorica di questi risultati è illustrata in figura 1. Gli individui con una CR maggiore possono tollerare di più la patologia così che il punto in cui le funzioni cognitive iniziano ad essere danneggiate sarà più avanti di quelli con CR più bassa. Tuttavia, abbiamo concluso che c'è un punto comune in tutte le persone, in cui la patologia è così grave che la funzione non può essere conservata. Dati questi presupposti, gli individui con CR più alta inizieranno il loro declino cognitivo quando la patologia è più avanzata e quindi c'è meno tempo fino al raggiungimento del punto in cui la patologia travolge le funzioni. Ciò si traduce in un tasso più rapido di declino, una volta che è iniziato.
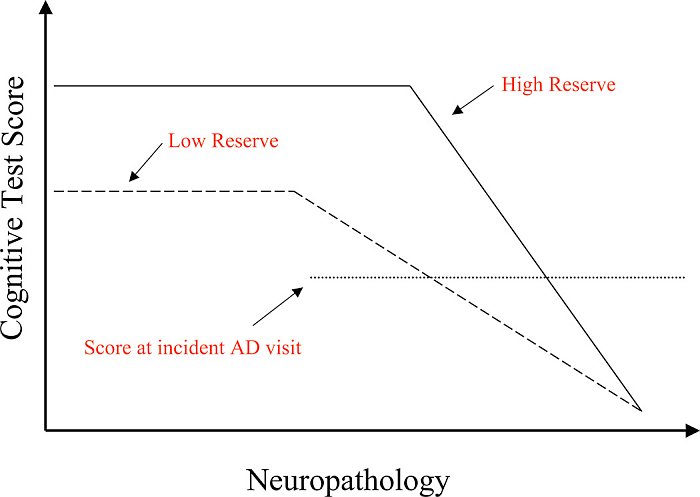 Figura 1. Questo dato ipotetico illustra come la funzione di memoria cambia nel tempo negli individui con riserva alta e bassa. In assenza di patologia di AD, è probabile che gli individui con riserva più elevata abbiano prestazioni migliori nei test di memoria, anche se questo non è stato accertato universalmente. La patologia di AD comincia ad avanzare prima di qualsiasi osservazione del cambiamento nelle prestazioni di memoria. Tuttavia, ad un certo punto la patologia è sufficiente per causare cali notevoli nei punteggi dei test di memoria. Questo punto, dove le prestazioni cominciano a declinare, è più avanti negli individui con riserva più alta, perché possono tollerare di più la patologia prima che influisca sulle prestazioni. La figura ipotizza un punto in cui la patologia è così grave che le prestazioni della memoria sono nulle. Questo punto è lo stesso sia per gli individui con riserva alta che bassa. Dato questo punto in comune, la figura ipotizza che una volta che comincia il declino della memoria, il tasso di declino dovrebbe essere più rapido nei soggetti con riserva alta che in quelli con riserva più bassa. Questo modello teorico spiega le osservazioni di un declino clinico più rapido dei pazienti di AD con riserva superiore. Secondo questo modello, questo tasso differenziale di declino può essere osservato sia negli individui che hanno AD già diagnosticato come in quelli per cui la memoria ha iniziato a diminuire.
Figura 1. Questo dato ipotetico illustra come la funzione di memoria cambia nel tempo negli individui con riserva alta e bassa. In assenza di patologia di AD, è probabile che gli individui con riserva più elevata abbiano prestazioni migliori nei test di memoria, anche se questo non è stato accertato universalmente. La patologia di AD comincia ad avanzare prima di qualsiasi osservazione del cambiamento nelle prestazioni di memoria. Tuttavia, ad un certo punto la patologia è sufficiente per causare cali notevoli nei punteggi dei test di memoria. Questo punto, dove le prestazioni cominciano a declinare, è più avanti negli individui con riserva più alta, perché possono tollerare di più la patologia prima che influisca sulle prestazioni. La figura ipotizza un punto in cui la patologia è così grave che le prestazioni della memoria sono nulle. Questo punto è lo stesso sia per gli individui con riserva alta che bassa. Dato questo punto in comune, la figura ipotizza che una volta che comincia il declino della memoria, il tasso di declino dovrebbe essere più rapido nei soggetti con riserva alta che in quelli con riserva più bassa. Questo modello teorico spiega le osservazioni di un declino clinico più rapido dei pazienti di AD con riserva superiore. Secondo questo modello, questo tasso differenziale di declino può essere osservato sia negli individui che hanno AD già diagnosticato come in quelli per cui la memoria ha iniziato a diminuire.
Anche se questi studi epidemiologici sono di supporto al concetto di riserva cognitiva, essi non possono essere considerati prove definitive. Solo studi controllati possono veramente stabilire che alcune serie di interventi o di esperienze sono utili. Questo è discusso nel seguito.
Studi di neuroimaging della riserva cognitiva
Scansioni acquisite a riposo
Gli studi epidemiologici suggeriscono che, in un dato livello di gravità clinica di AD, un individuo con un livello superiore di CR dovrebbe avere maggiore patologia AD. Questa idea è illustrata nella figura 2. L'abbiamo testata usando il flusso ematico cerebrale regionale (rCBF) a riposo come surrogato della patologia AD (30), (31). In pazienti di AD con gravità clinica simile, abbiamo trovato una relazione inversa tra rCBF a riposo e anni di istruzione (32). Una scolarità superiore è stata associata a un flusso più povero nella zona parieto-temporale, il luogo dei cambiamenti PET nell'AD. Questi risultati sono illustrati nella figura 3 (da Stern 1992 # 4423).
Questa osservazione ci ha dato qualche indicazione iniziale che i pazienti con più CR possono tollerare di più la patologia AD rispetto a quelli con più meno CR e sembrare comunque clinicamente simili. Un'analisi simile ha dimostrato un effetto protettivo comparabile della realizzazione professionale (33) e delle attività del tempo libero (34). Le osservazioni dedotte dall'uso del flusso ematico cerebrale sono state replicate da altri gruppi (35), (36) e poi, in seguito, da uno studio post-mortem. I ricercatori hanno esaminato il cervello di 130 anziani che avevano subito una valutazione cognitiva e poi l'autopsia, scoprendo che l'istruzione, e una misura sintetica della patologia di Alzheimer, sono associati alle prestazioni cognitive prima della morte. Inoltre, hanno scoperto che l'educazione ha modificato l'associazione tra patologia AD e livelli delle funzioni cognitive misurate prima della morte. Per ogni anno di istruzione addizionale, la relazione tra la patologia e la cognizione si è ridotta di 0,088 unità standard. Per cui ad ogni dato livello di patologia cerebrale, la maggiore scolarità si è associata a una migliore funzione cognitiva (37).
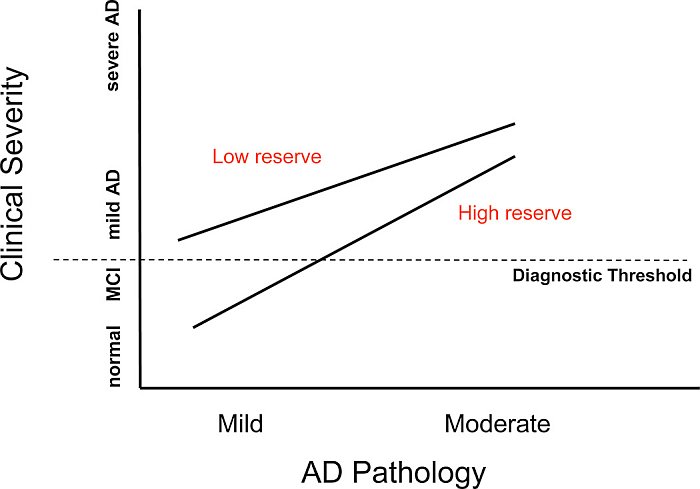 Figura 2. Questa figura descrive gli effetti teorici dei diversi livelli di patologia AD, in ascisse, e della gravità clinica, sulle ordinate. Quando la patologia AD è lieve, gli individui con livelli più bassi di riserva potrebbero già mostrare demenza clinicamente evidente, mentre quelli con riserva superiore potrebbero apparire clinicamente normali. Ai livelli più alti di patologia, entrambi i gruppi potrebbero apparire clinicamente dementi. Eppure, quelli con riserva maggiore potranno sembrare clinicamente meno gravi rispetto a quelli con riserva più bassa.
Figura 2. Questa figura descrive gli effetti teorici dei diversi livelli di patologia AD, in ascisse, e della gravità clinica, sulle ordinate. Quando la patologia AD è lieve, gli individui con livelli più bassi di riserva potrebbero già mostrare demenza clinicamente evidente, mentre quelli con riserva superiore potrebbero apparire clinicamente normali. Ai livelli più alti di patologia, entrambi i gruppi potrebbero apparire clinicamente dementi. Eppure, quelli con riserva maggiore potranno sembrare clinicamente meno gravi rispetto a quelli con riserva più bassa.
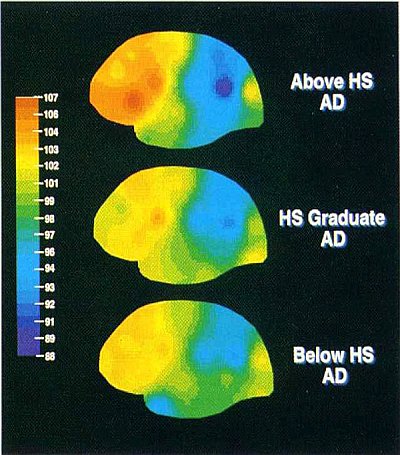 Figura 3. Questa è una figura tratta dal nostro primo studio che ha testato l'idea che in un dato livello di gravità clinica, i pazienti di AD con CR più alta dovrebbero avere patologia AD più avanzata. In questo studio, abbiamo usato una misura del flusso ematico cerebrale come marcatore della patologia AD. La figura riassume tre gruppi di 20 pazienti affetti da AD, tutti accuratamente abbinati per gravità clinica, misurata come stato mentale e attività della vita quotidiana. Si noti che il gruppo con il più alto livello di istruzione ha il blu più scuro nella zona parieto-temporale, che indica il livello più basso di flusso di sangue e, a sua volta patologia AD più avanzata. Questo dato suggerisce che, anche se i tre gruppi sono abbinati per gravità clinica, quelli con livelli più elevati di istruzione hanno maggiori livelli di patologia sottostante.
Figura 3. Questa è una figura tratta dal nostro primo studio che ha testato l'idea che in un dato livello di gravità clinica, i pazienti di AD con CR più alta dovrebbero avere patologia AD più avanzata. In questo studio, abbiamo usato una misura del flusso ematico cerebrale come marcatore della patologia AD. La figura riassume tre gruppi di 20 pazienti affetti da AD, tutti accuratamente abbinati per gravità clinica, misurata come stato mentale e attività della vita quotidiana. Si noti che il gruppo con il più alto livello di istruzione ha il blu più scuro nella zona parieto-temporale, che indica il livello più basso di flusso di sangue e, a sua volta patologia AD più avanzata. Questo dato suggerisce che, anche se i tre gruppi sono abbinati per gravità clinica, quelli con livelli più elevati di istruzione hanno maggiori livelli di patologia sottostante.
Meccanismi neurali sottostanti la CR
Gli studi esaminati suggeriscono che le esperienze dell'intera vita (come istruzione, occupazione e attività del tempo libero), sono in grado di fornire riserva contro l'età o la patologia legata all'AD. Tuttavia è tuttora sconosciuto il meccanismo cognitivo o neurale che sottende tale riserva.
Il nostro gruppo si è concentrato sull'uso delle scansioni funzionali per identificare le reti che potrebbero mediare la CR. L'implementazione neurale della CR può assumere due forme: riserva neurale e compensazione neurale (16), (38). La prima realizza l'idea che la CR potrebbe essere associata con le differenze individuali nella resilienza delle reti cognitive preesistenti. La seconda suggerisce che alcuni individui possono essere in grado di reclutare risorse compensative meglio di altri.
L'idea chiave che sta dietro la riserva neurale è che la CR potrebbe essere mediata dalle stesse reti che sono usate dalle persone in assenza di patologia collegata all'età o alle malattie. Ad esempio, l'efficienza differenziale o la capacità di queste reti possono spiegare le differenze individuali nelle prestazioni, nonché le differenze individuali nella capacità di far fronte ai cambiamenti del cervello.
In uno studio con fMRI, abbiamo esaminato il problema dell'efficienza e della capacità della rete, di adulti giovani e anziani (39). Abbiamo manipolato la difficoltà estrinseca di un compito, variando sistematicamente il termine ultimo di risposta. Con un metodo di covarianza per analizzare i dati di scansione, abbiamo identificato un modello spaziale di attivazione della fMRI che era espresso da entrambi i gruppi e la cui espressione aumentava con la difficoltà del compito.
Questo modello è stato espresso in misura maggiore dal gruppo di anziani, rispetto a quello dei giovani, quando il compito era più facile, coerentemente con l'idea che il gruppo più anziano aveva un'efficienza ridotta della rete. Al contrario, il modello è stato espresso in misura maggiore dal gruppo più giovane, quando il compito era più difficile, in linea con l'idea che, a fronte di esigenze più alte, i partecipanti più giovani ottengono risultati migliori rispetto agli anziani a causa di una maggiore capacità di rete. Le differenze riscontrate in termini di efficienza e di capacità tra i due gruppi di età sono presenti anche in tutti gli individui all'interno di ciascun gruppo di età. E' possibile che gli individui con reti più efficienti o più capaci possano avere più resilienza a fronte dei cambiamenti connessi a età o malattie.
Anche una serie di studi di imaging hanno esplorato la questione della riserva e della compensazione neurale. Adulti sani, giovani e anziani sono stati valutati con il compito «Lettera di Sternberg». In questo compito, i soggetti studiano 1, 3 o 6 lettere per 3 secondi (fase di stimolo), seguita da una fase di ritenzione di 7 secondi. Vedono poi una singola lettera sonda e devono indicare se quella lettera fa parte del gruppo studiato in precedenza. Per la nostra analisi fMRI, eravamo interessati sopratutto agli aspetti di attivazione che cambiano in funzione dell'aumento del numero di lettere che sono studiate; quello che abbiamo chiamato «attivazione legata al carico».
Usando un approccio analitico di covarianza (modellazione lineare multivariata, MLM) abbiamo scoperto che l'«attivazione legata al carico» durante la fase di ritenzione del compito è caratterizzata da due reti fMRI (40). Ciascuna di queste reti è un gruppo di aree cerebrali che sembrano funzionare insieme con la crescita di difficoltà del compito. Questo si desume dall'osservazione che lì la variazione del segnale fMRI, a seguito della maggiore difficoltà del compito, è correlata a tutti questi settori. La prima rete è stata usata sia dai soggetti giovani che da quelli anziani, e consisteva di aree spesso associate con la memoria. Al contrario, la seconda rete è stata caratterizzata principalmente dall'attivazione nelle aree para-ippocampali ed è stato usata costantemente solo dai soggetti anziani.
È importante sottolineare che i soggetti più anziani che hanno usato di più questo secondo modello hanno ottenuto risultati peggiori sul compito. Nell'analisi (41) successiva, abbiamo scoperto che l'atrofia in un settore chiave all'interno della prima rete (quella usata da tutti) è associata ad una ridotta efficienza di tale rete e a un maggiore utilizzo della seconda rete. Questa osservazione è coerente con l'idea che i cambiamenti legati all'età limitano l'efficienza della prima rete, e che gli anziani reclutano sempre più la rete alternativa. Coloro che si affidano di più a questa rete alternativa possono ancora svolgere il compito, ma lo fanno peggio. Questa scoperta è un esempio di compensazione neurale.
Un'altra analisi (42) ha valutato il ruolo della CR nelle scoperte appena descritte e ha trovato due influenze distinte della CR (come misurato dall'IQ). In primo luogo, gli individui con maggiore CR potevano tollerare più atrofia nella prima rete e mantenere comunque prestazioni di quella rete senza dover ricorrere all'uso della seconda rete. In secondo luogo, quelli con una maggiore CR sono andati meglio, rispetto ai soggetti con CR più bassa, anche quando usano la seconda rete.
Quest'ultima scoperta suggerisce che la CR può usare risorse cognitive che sono separate da quelle coinvolte direttamente nelle prestazioni dei compiti. Questo è coerente con l'idea che ci può essere qualche rappresentazione neurale generalizzata della CR che potrebbe conferire una protezione in una vasta gamma di attività. Al fine di indagare questa possibilità, abbiamo analizzato i dati di scansione di persone che svolgono due compiti diversi con varie esigenze (43).
In un gruppo di soggetti giovani abbiamo identificato una rete di attivazione che era stata espressa durante la fase di presentazione dello stimolo in entrambi i compiti e il cui aumento dell'espressione con carico sempre maggiore si correlava alla CR. Questa rete osservata è coerente con una esemplificazione neurale della CR.
In futuro, individuare un modello neurale dell'attivazione associata alla CR generica potrebbe essere un modo diretto per misurare il livello di riserva di un individuo. Inoltre, un modello neurale quantificabile di CR fornirebbe una stratificazione o misura dell'esito utile per gli studi farmacologici o non-farmacologici volti a migliorare il funzionamento cognitivo.
Applicazione della riserva cognitiva alla pratica clinica
Questa sezione contiene alcune considerazioni per l'applicazione della CR nella pratica clinica. Nel valutare la cognizione nell'ambito di una diagnosi, è importante prendere in considerazione l'indicatore più adeguato valido di CR per un dato paziente. Nel caso in cui il livello di istruzione di un individuo non sia ritenuto una buona rappresentazione del suo funzionamento cognitivo ottimale, una stima più accurata può derivare dalla valutazione del QI o considerare l'occupazione.
E' cruciale integrare nella formulazione della diagnosi la misura più appropriata e valida della CR. Gli individui con riserva elevata, per definizione, non dimostreranno sintomi clinici connessi alla malattia altrettanto presto di quelli con livelli bassi di riserva. Questo problema potrebbe parzialmente essere affrontato con la strumentazione, in modo tale che: 1) i test più impegnativi con punteggi massimi più alti possano rilevare meglio i cambiamenti nelle persone con livelli molto elevati di funzionamento, 2) i test che sono più specifici per la patologia (es.: attività di apprendimento associativo per l'ippocampo) possono avere una maggiore sensibilità in individui con riserva alta. Tuttavia, i medici devono essere consapevoli che, in presenza di patologia, ci dovrebbe comunque essere un periodo di tempo durante il quale anche le misure più sensibili potrebbero non rilevare il cambiamento cognitivo.
Per scopi diagnostici le informazioni riguardanti l'integrità del cervello potrebbero essere integrate con dati conoscitivi. Gli strumenti di neuroimaging hanno il potenziale (in particolare negli individui con alta riserva che mantengono le funzioni cognitive per un periodo di tempo prolungato) di rilevare le alterazioni patologiche quando il deterioramento è elusivo sui test neuropsicologici. Per esempio, ad un dato livello di gravità clinica, i pazienti AD con istruzione superiore hanno un modello più grave dei cambiamenti legati all'AD sulla PET rispetto a quelli con scolarità bassa (44), (45). Quindi il neuroimaging potrebbe essere un aiuto per una diagnosi efficace.
E' comunque prematuro integrare questo concetto nella pratica quotidiana. Oggi è possibile rilevare la presenza di amiloide nel cervello sia con la PET che con un test del liquido cerebrospinale, ma le implicazioni prognostiche di questi test non sono del tutto sicure. Tuttavia, la disponibilità di questi biomarcatori fornisce una via feconda per la ricerca sulla riserva cognitiva.
La CR dovrebbe essere riconosciuta come un fattore che influenzerà il tasso di declino cognitivo dopo la diagnosi. Il tasso di declino è più rapido negli individui con riserva alta rispetto a quelli con riserva bassa, anche se si tiene conto di una moltitudine di altri fattori che possono contribuire al decorso della malattia (27), (28), (46). Questo ha rilevanza diretta per valutare l'efficacia del trattamento.
Dato il meccanismo previsto di un particolare farmaco, può avere effetti divergenti in funzione del grado di patologia sottostante. Inoltre, la maggior parte degli studi clinici sono progettati per confrontare il tasso di declino tra un gruppo trattato e quello con placebo. Una mancata corrispondenza nella CR tra questi due gruppi potrebbe portare a tassi di declino differenziali che non hanno nulla a che fare con il farmaco in fase di studio.
Infine, l'evidenza epidemiologica che collega alcune esperienze di vita e le caratteristiche individuali a tassi più bassi di demenza, non è sufficiente a stabilire definitivamente quali esperienze prevengono o ritardano direttamente la demenza. Sono necessari studi di intervento per stabilire con fermezza i nessi causali tra esperienze di vita, caratteristiche individuali, e CR, e tali studi sono in corso.
Pertanto, mentre raccomandare ai pazienti di impegnarsi in alcune attività, come l'arricchimento mentale e la forma fisica, non ha probabilità di essere nocivo e può invece avere numerosi effetti positivi, i medici dovrebbero essere attenti a non presentare queste attività come trattamenti assodati o strategie preventive pienamente provate contro la demenza.
Implicazioni della riserva cognitiva sulla cura e la prevenzione
L'evidenza epidemiologica suggerisce che le esperienze in tutte le fasi della vita, anche in età avanzata, possono conferire tale riserva. Questi risultati supportano la possibilità che possa essere possibile intervenire anche tardi nella vita per creare riserva, rallentare il declino cognitivo legato all'età, e prolungare l'invecchiamento sano.
L'approccio di cura più riuscito fino ad oggi è stato l'esercizio aerobico. Molti studi controllati su individui anziani hanno dimostrato che, negli individui con capacità respiratoria meno che mediana, l'esercizio aerobico che aumenta la capacità respiratoria si traduce anche in aumento delle prestazioni cognitive (47), (48).
I risultati degli studi di intervento cognitivo sono stati più altalenanti. In uno dei più grandi di tali studi non c'era alcuna prova che l'allenamento di un dominio cognitivo generalizzasse le prestazioni ad altri due domini. Inoltre, non vi sono prove convincenti che la formazione porti ad alcun miglioramento nelle attività della vita quotidiana (49).
Sono stati più promettenti gli studi che hanno immerso i soggetti in giochi complessi. Ad esempio, Basak et al. (50) hanno fatto giocare a degli anziani un gioco complesso di ruolo ("Rise of Nations") per 23 ore e mezza, e hanno dimostrato che giocare è associato a un miglioramento delle prestazioni su una vasta gamma di compiti cognitivi.
Allo stesso modo, la formazione focalizzata ha migliorato la capacità della memoria di lavoro e ha mostrato il trasferimento dell'allenamento ai compiti di memoria non allenati (51). Nella schizofrenia sono stati notati piccoli effetti della cura cognitiva, in particolare nei pazienti stabili e quando era combinata con ulteriore riabilitazione (52). Sono state raggiunte analoghe conclusioni circa le limitazioni e le promesse di intervento cognitivo da un recente gruppo di lavoro (53).
Il nostro gruppo ha lavorato con un altro gioco complesso ("Space Fortress"), progettato da psicologi di operazioni umane come banco di prova di approcci di formazione per insegnare compiti complessi a giovani adulti (54). Nella ricerca sui giovani adulti, un particolare approccio formativo ha prodotto un eccellente miglioramento nel gioco, ma, cosa più importante, ha anche mostrato un trasferimento della formazione ad altri compiti. In questo approccio, che si chiama «allenamento al cambio di enfasi», i giocatori sono incaricati di concentrarsi su tutte le caratteristiche del gioco, ma di dare particolare enfasi a una caratteristica specifica durante ogni gioco individuale.
Spostando l'enfasi da un gioco all'altro, i partecipanti non possono fissarsi in una strategia unica. Essi devono sviluppare la capacità di affrontare l'intera attività nel suo complesso, competenze che potrebbero essere definite «allocazione attenzionale» o «controllo esecutivo». I giovani che imparano a giocare con questo approccio di allenamento sono più bravi a incorporare nuove esigenze mentre eseguono il gioco (55). Inoltre, dimostrano prestazioni più riuscite sui compiti del mondo reale, come il simulatore di volo o nelle prestazioni della formazione al volo (56), (57).
In uno studio preliminare con anziani, abbiamo esplorato la loro capacità di imparare il gioco, e la possibilità che giocando possano migliorare le prestazioni cognitive (58). 90 soggetti sono stati divisi in tre gruppi: (1) condizione di non-gioco, gioco senza (2) o con (3) allenamento al cambio di enfasi. I due gruppi hanno eseguito il gioco tre volte alla settimana per 12 settimane. È interessante notare che, anche se il gioco in sé era molto impegnativo per gli anziani, ci sono stati pochi abbandoni e le prestazioni sono migliorate nel tempo.
L'analisi delle varie caratteristiche del gioco ha indicato che gli anziani nella condizione di gioco puro non erano così concentrati sugli obiettivi chiave del gioco come il gruppo di cambio enfasi; erano più propensi a rispondere ai segnali dei punti bonus invece di tentare di distruggere la fortezza spaziale. Al contrario, gli anziani nella condizione di cambiamento di enfasi erano più propensi a concentrarsi su caratteristiche centrali del gioco, in particolare sono riusciti a distruggere la fortezza spaziale meglio dei coetanei dell'altro gruppo.
Le nostre misure cognitive primarie erano 5 attività che coinvolgono il controllo esecutivo. In uno di questi compiti, un test di memoria di lavoro, il gruppo di cambio di enfasi ha mostrato un miglioramento maggiore dal pre al post-test, rispetto agli altri due gruppi. Questa, la consideriamo una scoperta promettente, e attualmente stiamo conducendo uno studio che combina il gioco "Fortezza Spaziale" con l'esercizio aerobico.
Grazie alla combinazione di un intervento cognitivo con l'esercizio aerobico speriamo in un effetto sinergico. L'esercizio aerobico può in effetti aumentare la riserva cerebrale, per esempio migliorando la plasticità attraverso la sovra-regolazione del BDNF. L'intervento cognitivo, a sua volta, può contribuire ad aumentare la CR sostenendo l'efficienza delle reti cognitive sottostanti il controllo esecutivo. Questa forma dei dati cognitivi sarebbe facilitata dal livello migliorato di riserva cerebrale.
Più in generale, i dati epidemiologici indicano chiaramente che gli aspetti delle esperienze di vita sono in grado di conferire riserva contro le patologie dell'età o correlate alla malattia. Tuttavia, la "ricetta" esatta per creare questa riserva è ancora sconosciuta. Una raccomandazione generica sarebbe quella di mantenere attività istruttive e mentalmente stimolanti per tutta la vita (59). Raccomandazioni specifiche attendono interventi di ricerca più mirati, su larga scala.
Gli endpoint (obiettivi) più significativi per un tale intervento sarebbero il rallentamento del tasso di declino cognitivo nell'invecchiamento o la riduzione del rischio di sviluppare l'Alzheimer. Nessuno studio finora ha mostrato cambiamenti in uno di questi endpoint. Dovrebbe iniziare in modo ottimale dagli anziani cognitivamente intatti, e seguirli per un congruo periodo di tempo. Molto probabilmente, questi studi dovrebbero usare strategie multiple di intervento che comprendono esercizio, stimolazione cognitiva e stimolazione sociale. Gli studi che usano questi endpoint saranno molto costosi perché richiedono un gran numero di partecipanti e dovranno essere condotti per diversi anni.
Conclusione
Il concetto di CR è emerso per la prima volta da osservazioni epidemiologiche. Anche se gli studi epidemiologici possono descrivere solo le correlazioni e non provare direttamente causalità, sono utili per ricavare ipotesi ed esplorare idee. Una quantità di studi epidemiologici suggeriscono che una serie di esperienze di vita sembrano essere associate ad una riserva contro le patologie dell'età o correlate all'AD.
Mentre le osservazioni originali riguardano variabili facilmente misurabili, come l'istruzione o la realizzazione professionale, gli studi più recenti sono entrati di più nello stile di vita, nei comportamenti cognitivamente stimolanti, nei fattori di personalità e simili. Nel loro insieme, essi suggeriscono che i contributi alla riserva provengono da più fonti, e che la riserva non è un'entità fissa, ma può cambiare nel corso della vita a seconda delle esperienze e dei comportamenti.
Si tratta di una idea piena di speranza, poiché suggerisce che i cambiamenti nello stile di vita anche nella vita avanzata potrebbero conferire riserva contro il declino cognitivo legato all'età o alla demenza. Nonostante questa entusiasmante possibilità, sono necessari studi accuratamente controllati per tradurre questa idea in un intervento pratico. Tali studi potrebbero fornire informazioni pratiche, sia sulla combinazione che sulla tempistica delle attività che possono portare a un invecchiamento migliore.
Il desiderio di comprendere le basi neurali della CR è stato un fattore motivante degli studi di imaging funzionale che possono contribuire a capire i cambiamenti cerebrali-comportamentali che avvengono nell'invecchiamento. Le informazioni sulle basi neurali della riserva cognitiva potrebbero produrre informazioni che consentono agli interventi di essere più mirati. Potrebbero essere molto utili le misure neurali dirette della riserva cognitiva, forse sulla base di modelli derivati da studi di fMRI, come pure l'esame del concetto di CR in ambito clinico.
Da un punto di vista pratico, si può integrare la riserva cognitiva nella formulazione diagnostica di un medico. Il fatto che una maggiore CR sia associata a declino più rapido nei pazienti con Alzheimer, rende importante assicurarsi che la CR sia considerata negli studi clinici che si basano sulle differenze nel tasso di declino tra pazienti trattati con farmaci e placebo.
A questo proposito, sarebbero molto utili i correlati neuronali della riserva direttamente misurabili, ad esempio un modello fMRI. Più in generale, la considerazione della riserva cognitiva e cerebrale ci spinge ad un approccio basato di più sui sistemi per capire le condizioni legate ai cambiamenti cerebrali. Dal momento che il cervello cerca, sia passivamente che attivamente, di far fronte ai cambiamenti cerebrali o alle patologie, è importante capire i fattori che contribuiscono a questa resilienza.
Note
Questo lavoro è stato finanziato dal National Intitute on Aging che non ha avuto alcun ruolo nel progetto dello studio, nella raccolta/analisi/interpretazione dei dati, nella stesura della relazione o nella decisione di presentare la ricerca per la pubblicazione. Il dottor Stern ha preparato questo manoscritto. Non ci sono conflitti di interesse.
Referenze
1. Gurland B. The borderlands of dementia: the influence of sociocultural characteristics on rates of dementia occurring in the senium. Aging. 1981;15:61–84.
2. Kittner SJ, White LR, Farmer ME, Wolz M, Kaplan E, Moes E, et al. Methodological issues in screening for dementia: The problem of education adjustment. Journal of Chronic Diseases. 1986;39:163–170. [PubMed]
3. Berkman LF. The association between educational attainment and mental status examinations: Of etiologic significance for senile dementias or not? Journal of Chronic Diseases. 1986;39:171–174. [PubMed]
4. Zhang M , Katzman R, Salmon D, Jin H, Cai G, Wang Z, et al. The prevalence of dementia and Alzheimer's disease in Shanghai, China: Impact of age, gender and education. Annals of Neurology. 1990;27:428–437. [PubMed]
5. Elkins JS, Longstreth WT, Manolio TA, Newman AB, Bhadelia RA, Johnston SC. Education and the cognitive decline associated with MRI-defined brain infarct. Neurology. 2006;67(3):435–440. [PubMed]
6. Dufouil C, Alperovitch A, Tzourio C. Influence of education on the relationship between white matter lesions and cognition. Neurology. 2003;60(5):831–836. [PubMed]
7. Dufouil C, Alperovitch A, Ducros V, Tzourio C. Homocysteine, white matter hyperintensities, and cognition in healthy elderly people. Ann Neurol. 2003;53(2):214–221. [PubMed]
8. Glatt SL, Hubble JP, Lyons K, Paolo A, Troster AI, Hassanein RE, et al. Risk factors for dementia in Parkinson's disease: effect of education. Neuroepidemiology. 1996;15:20–25. [PubMed]
9. Kesler SR, Adams HF, Blasey CM, Bigler ED, et al. Premorbid intellectual functioning, education, and brain size in traumatic brain injury: An investigation of the cognitive reserve hypothesis. Applied Neuropsychology. 2003;10:153–162. [PubMed]
10. Farinpour R, Miller EN, Satz P, Selnes OA, Cohen BA, Becker JT, et al. Psychosocial risk factors of HIV morbidity and mortality: findings from the Multicenter AIDS Cohort Study (MACS) Journal of Clinical and Experimental Neuropsychology. 2003;25:654–670. [PubMed]
11. Barnett JH, Salmond CH, Jones PB, Sahakian BJ. Cognitive reserve in neuropsychiatry. Psychological Medicine. 2006;36:1053–1064. [PubMed]
12. Sumowski JF, Chiaravalloti N, Deluca J. Cognitive reserve protects against cognitive dysfunction in multiple sclerosis. J Clin Exp Neuropsychol. 2009;31(8):913–926. [PubMed]
13. Katzman R, Robert T, DeTeresa R, Brown T, Peter D, Fuld P, et al. Clinical, pathological, and neurochemical changes in dementia: a subgroup with preserved mental status and numerous neocortical plaques. Annals of Neurology. 1988;23(2):138–144. [PubMed]
14. Schofield PW, Logroscino G, Andrews H, Albert S, Stern Y. An association between head circumference and Alzheimer's disease in a population based study of aging. Neurology. 1997;49:30–37. [PubMed]
15. Stern Y. What is cognitive reserve? Theory and research application of the reserve concept. Journal of the International Neuropsychological Society. 2002;8:448–460. [PubMed]
16. Stern Y. Cognitive reserve. Neuropsychologia. 2009;47:2015–2028. [PMC free article] [PbMed]
17. Brown J, Cooper-Kuhn CM, Kemperman G, van Praag H, Winkler J, Gage FH. Enriched environment and physical activity stimulate hippocampal but not olfactory bulb neurogenesis. EUROPEAN JOURNAL OF NEUROSCIENCE. 2003;17:2042–2046. [PubMed]
18. van Praag H, Christie BR, Sejnowski TJ, Gage FH. Running enhances neurogenesis, learning, and long-term potentiation in mice. Proc Natl Acad Sci U S A. 1999;96(23):13427–13431. [PMC free article] [PubMed]
19. van Praag H, Kemperman G, Gage FH. Running increases cell proliferation and neurogenesis in the adult mouse dentate gyrus. Nature Neuroscience. 1999;2:266–270. [PubMed]
20. van Praag H, Kempermann G, Gage FH. Neural consequences of environmental enrichment. Nat Rev Neurosci. 2000;1(3):191–198. [PubMed]
21. Valenzuela MJ, Sachdev P, Wen W, Chen X, Brodaty H. Lifespan mental activity predicts diminished rate of hippocampal atrophy. PLoS One. 2008;3(7):e2598. [PMC free article] [PubMed]
22. Landau SM, Marks SM, Mormino EC, Rabinovici GD, Oh H, O'Neil JP, et al. Association of Lifetime Cognitive Engagement and Low beta-Amyloid Deposition. Arch Neurol. 2012 [PMC free article] [PubMed]
23. Stern Y, Gurland B, Tatemichi TK, Tang MX, Wilder D, Mayeux R. Influence of education and occupation on the incidence of Alzheimer's disease. Journal of the American Medical Association. 1994;271:1004–1010. [PubMed]
24. Scarmeas N, Levy G, Tang MX, Manly J, Stern Y. Influence of leisure activity on the incidence of Alzheimer's disease. Neurology. 2001;57(12):2236–2242. [PMC free article] [PubMed]
25. Valenzuela MJ, Sachdev P. Brain reserve and dementia: a systematic review. Psychol Med. 2005;25:1–14. [PubMed]
26. Stern Y, Tang MX, Denaro J, Mayeux R. Increased risk of mortality in Alzheimer's disease patients with more advanced educational and occupational attainment. Annals of Neurology. 1995;37:590–595. [PubMed]
27. Stern Y, Albert S, Tang MX, Tsai WY. Rate of memory decline in AD is related to education and occupation: Cognitive reserve? Neurology. 1999;53:1942–1957. [PubMed]
28. Scarmeas N, Albert SM, Manly JJ, Stern Y. Education and rates of cognitive decline in incident Alzheimer's disease. Journal of Neurology, Neurosurgery & Psychiatry. 2006;77(3):308–316. [PMC free article] [PubMed]
29. Helzner EP, Scarmeas N, Cosentino S, Portet F, Stern Y. Leisure activity and cognitive decline in incident Alzheimer disease. Archives of Neurology. 2007;64(12):1749–1754. [PubMed]
30. Friedland RP, Brun A, Bundinger TF. Pathological and positron emission tomographic correlations in Alzheimer's disease. Lancet. 1985:1–228. [PubMed]
31. McGeer EG, Peppard RP, McGeer PL, et al. 18Fluorodeoxyglucose positron emission tomography studies in presumed Alzheimer cases, including 13 serial scans. Canadian Journal of Neurological Sciences. 1990;17:1–11. [PubMed]
32. Stern Y, Alexander GE, Prohovnik I, Mayeux R. Inverse relationship between education and parietotemporal perfusion deficit in Alzheimer's disease. Annals of Neurology. 1992;32:371–375. [PubMed]
33. Stern Y, Alexander GE, Prohovnik I, Stricks L, Link B, Lennon MC, et al. Relationship between lifetime occupation and parietal flow: Implications for a reserve against Alzheimer's disease pathology. Neurology. 1995;45:55–60. [PubMed]
34. Scarmeas N, Zarahn E, Anderson KE, Habeck CG, Hilton J, Flynn J, et al. Association of life activities with cerebral blood flow in Alzheimer disease - Implications for the cognitive reserve hypothesis. Archives of Neurology. 2003;60:359–365. [PMC free article] [PubMed]
35. Alexander GE, Furey ML, Grady CL, Pietrini P, Brady DR, Mentis MJ, et al. Association of premorbid intellectual function with cerebral metabolism in Alzheimer's disease: implications for the cognitive reserve hypothesis. Am J Psychiatry. 1997;154(2):165–172. [PubMed]
36. Perneczky R, Drzezga A, ehl-Schmid J, Schmid G, Wohlschlager A, Kars S, et al. Schooling mediates brain reserve in Alzheimer's disease: findings of fluoro-deoxy-glucose-positron emission tomography. J Neurol Neurosurg Psychiatry. 2006;77(9):1060–1063. [PMC free article] [PubMed]
37. Bennett DA, Wilson RS, Schneider JA, Evans DA, Mendes De Leon CF, Arnold SE, et al. Education modifies the relation of AD pathology to level of cognitive function in older persons. Neurology. 2003;60(12):1909–1915. [PubMed]
38. Stern Y, Habeck C, Moeller J, Scarmeas N, Anderson KE, Hilton HJ, et al. Brain networks associated with cognitive reserve in healthy young and old adults. CerebCortex. 2005;15(4):394–402. [PMC free article] [PubMed]
39. Stern Y, Rakitin BC, Habeck C, Gazes Y, Steffener J, Kumar A, et al. Task difficulty modulates young-old differences in network expression. Brain Res. 2012;1435:130–145. [PMC free article] [PubMed]
40. Zarahn E, Rakitin B, Abela D, Flynn J, Stern Y. Age-related changes in brain activation during a delayed item recognition task. Neurobiol Aging. 2007;28(5):784–798. [PubMed]
41. Steffener J, Brickman AM, Rakitin BC, Gazes Y, Stern Y. The impact of structure on age-related changes in working memory functional activity. Brain Imaging and Behavior. 2008 [PMC free article] [PubMed]
42. Steffener J, Reuben A, Rakitin BC, Stern Y. Supporting performance in the face of age-related neural changes: testing mechanistic roles of cognitive reserve. Brain Imaging Behav. 2011 [PMC free article] [PubMed]
43. Stern Y, Zarahn E, Habeck C, Holtzer R, Rakitin BC, Kumar A, et al. A common neural network for cognitive reserve in verbal and object working memory in young but not old. Cerebral Cortex. 2008;18:959–967. [PMC free article] [PubMed]
44. Garibotto V, Borroni B, Kalbe E, Herholz K, Salmon E, Holtoff V, et al. Education and occupation as proxies for reserve in aMCI converters and AD: FDG-PET evidence. Neurology. 2008;71(17):1342–1349. [PubMed]
45. Kemppainen NM, Aalto S, Karrasch M, Nagren K, Savisto N, Oikonen V, et al. Cognitive reserve hypothesis: Pittsburgh Compound B and fluorodeoxyglucose positron emission tomography in relation to education in mild Alzheimer's disease. Ann Neurol. 2008;63(1):112–118. [PubMed]
46. Hall CB, Derby C, LeValley A, Katz MJ, Verghese J, Lipton RB. Education delays accelerated decline on a memory test in persons who develop dementia. Neurology. 2007;69(17):1657–1664. [PubMed]
47. Angevaren M, Aufdemkampe G, Verhaar H, Aleman A, Vanhees L. Physical activity and enhanced fitness to improve cognitive function in older people without known cognitive impairment. Cochrane Database Syst Rev. 2008;2 CD005381. [PubMed]
48. Kramer AF, Hahn S, Cohen NJ, Banich MT, McAuley E, Harrison CR, et al. Ageing, fitness and neurocognitive function. Nature. 1999;400(6743):418–419. [PubMed]
49. Jobe JB, Smith DM, Ball K, Tennstedt SL, Marsiske M, Willis SL, et al. ACTIVE: a cognitive intervention trial to promote independence in older adults. Control Clin Trials. 2001;22(4):453–479. [PMC free article] [PubMed]
50. Basak C, Boot WR, Voss MW, Kramer AF. Can training in a real-time strategy video game attenuate cognitive decline in older adults? Psychology and Aging. 2008;23(4):765–777. [PMC free article] [PubMed]
51. Klingberg T. Training and plasticity of working memory. Trends Cogn Sci. 2010;14(7):317–324. [PubMed]
52. Wykes T, Huddy V, Cellard C, McGurk SR, Czobor P. A meta-analysis of cognitive remediation for schizophrenia: methodology and effect sizes. Am J Psychiatry. 2011;168(5):472–485. [PubMed]
53. The Royal Society. Brain Waves Module 2: Neuroscience: implications for education and lifelong learning. 2011 [cited; Available from: Royalsociety.org.
54. Mane ADE. The Space Fortress Game. Acta Psychologica. 1989;71:17–22.)
55. Fabiani M, Buckley J, Gratton G, Coles MGH, Donchin E. The training of Complex Task Performance. Acta Psychologica. 1989;71:259–299.)
56. Gopher D, Weil M, Bareket T. Transfer of skill from a computer game trainer to flight. Human Factors. 1994;36(3):387–405.)
57. Gopher D, Weil M, Siegal D. Practice under changing priorities: an approach to the training of complex skills. Acta Psychologica. 1989;71:147–177.)
58. Blumen HM, Gopher D, Steinerman JR, Stern Y. Training cognitive control in older adults with the space fortress game: the role of training instructions and basic motor ability. Front Aging Neurosci. 2010;2:145. [PMC free article] [PubMed]
59. Orrell M, )Sahakian B. Education and dementia. BMJ. 1995;310(6985):951–952. [PMC free article] [PubMed]
Fonte: PubMed Central (> English text)) - Traduzione di Franco Pellizzari).
Riferimenti: Yaakov Stern PhD. Cognitive reserve in ageing and Alzheimer's disease. Lancet Neurol. 2012 Nov; 11(11): 1006–1012. doi: 10.1016/S1474-4422(12)70191-6)
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui).
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.

 Associazione Alzheimer OdV
Associazione Alzheimer OdV