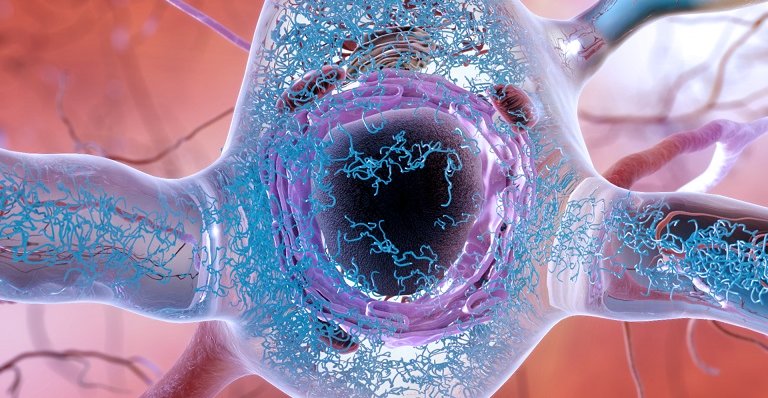
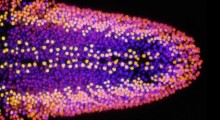
 Tau tossica all'interno di un neurone.
Tau tossica all'interno di un neurone.
Un team di ricerca coreano ha, per la prima volta al mondo, identificato a livello molecolare che tau e amiloide-β (Aβ), le due proteine patologiche chiave del morbo di Alzheimer (MA), comunicano direttamente per regolare la tossicità. Questo risultato dovrebbe fornire nuove intuizioni sulla patofisiologia della malattia, nonché indizi importanti per scoprire biomarcatori per la diagnosi precoce e lo sviluppo di terapie per vari disturbi cerebrali neurodegenerativi.
Il team di ricerca della prof.ssa Mi Hee Lim del Dipartimento di Chimica del KAIST, in collaborazione con il dott. Young-Ho Lee del Korea Basic Science Institute (KBSI) e i dott. Yun Kyung Kim e Sung Su Lim del Brain Science Institute (BSI), ha chiarito a livello molecolare che il dominio tau di legame ai microtubuli interagisce direttamente con l'Aβ, altera il suo percorso di aggregazione e allevia la tossicità cellulare.
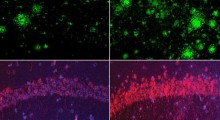
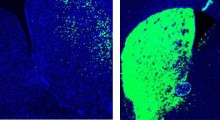
Patologicamente, il MA è caratterizzato dall'accumulo di 'grovigli neurofibrillari' formati da aggregati di tau, una proteina responsabile del trasporto di nutrienti e molecole di segnalazione all'interno dei neuroni e di 'placche amiloidi' (placche senili) formate da gruppi di frammenti di Aβ - scissi anormalmente dalla proteina precursore dell'amiloide, che è coinvolta nello sviluppo del cervello, nella segnalazione intercellulare e nel recupero neuronale - che si aggregano all'interno e intorno alle membrane neuronali nel cervello.
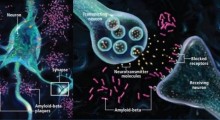
Sebbene tau e Aβ formino strutture patologiche in posizioni spazialmente separate, si è suggerito che possano coesistere all'interno e all'esterno delle cellule e potenzialmente interagire. Tuttavia, la comprensione a livello molecolare di come influisce la loro interazione diretta sull'insorgenza e la progressione della malattia non è stato chiaramente rivelato finora.
Il team congiunto di ricerca ha scoperto che tra le ripetizioni strutturali della proteina tau che si legano ai microtubuli (il sistema di trasporto intracellulare) all'interno dei neuroni - K18, R1-R4, PHF6* e PHF6 - in particolare K18, R2 e R3 si legano con l'amiloide per formare 'eterocomplessi tau-Aβ'. Questo processo è significativo perché l'Aβ si assembla normalmente in fibre rigide e altamente tossiche (fibrille amiloidi), ma quando certe regioni di tau si legano, l'Aβ si sposta su un percorso di aggregazione che produce aggregati meno tossici e meno rigidi.
In particolare, queste regioni ripetute di tau ritardano la fase di nucleazione (la fase iniziale dell'aggregazione amiloide legata all'insorgenza della malattia) e alterano contemporaneamente la velocità di aggregazione e la forma strutturale di Aβ associata alla progressione della malattia. Di conseguenza, la tossicità causata dall'Aβ si riduce notevolmente sia negli ambienti intracellulari che extracellulari del cervello.
In questo studio, il team ha combinato tecniche analitiche precise, che includono spettroscopia, spettrometria di massa, calorimetria isotermica di titolazione e risonanza magnetica nucleare, con test di tossicità basati su cellule per analizzare in modo completo le proprietà strutturali, termodinamiche e funzionali delle interazioni tau-Aβ.
I risultati hanno rivelato che regioni specifiche delle ripetizioni leganti i microtubuli tau possiedono caratteristiche sia idrofili (attraggono l'acqua) che idrofobiche (idrorepellenti) e quando l'equilibrio di queste due proprietà è ottimizzato, la tau si lega in modo più efficace all'Aβ. In altre parole, le proprietà intrinseche della tau determinano la sua affinità di legame con l'Aβ, la sua modulazione delle vie di aggregazione e la sua capacità di regolare la tossicità.
Il dott. Young-Ho Lee del KBSI ha dichiarato: “Questa ricerca ha scoperto un nuovo meccanismo molecolare per l'insorgenza e la progressione della demenza, una malattia neurodegenerativa intrattabile. In particolare, la ricerca convergente multidisciplinare si è focalizzata sulle interazioni molecolari e sull'aggregazione delle proteine che si crede abbiano un ruolo pivotale nel chiarire non solo la comunicazione tra MA e Parkinson, ma anche le interconnessioni tra varie malattie come demenza, diabete e cancro".
La prof.ssa Mi Hee Lim del KAIST ha aggiunto: “La proteina tau non contribuisce solo alla formazione patologica, ma, attraverso specifiche strutture ripetute che legano i microtubuli, esercita una funzione molecolare che mitiga attivamente l'aggregazione e la tossicità dell'Aβ. Questo fornisce un nuovo punto di svolta nella comprensione della patologia del MA, La significatività di questo studio sta nell'identificare nuovi motivi molecolari che potrebbero diventare obiettivi terapeutici, non solo per il MA, ma anche per vari disturbi neurodegenerativi del cervello basati sull'aggregazione proteica".
Fonte: KAIST-Korea Advanced Institute of Science and Technology (> English) - Traduzione di Franco Pellizzari.
Riferimenti: M Kim, [+6], M Hee Lim. Interactions with tau’s microtubule-binding repeats modulate amyloid-β aggregation and toxicity. Nat Chem Biol, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.




 Associazione Alzheimer OdV
Associazione Alzheimer OdV