Un meccanismo molecolare che contribuisce in modo significativo alla progressione del morbo di Alzheimer (MA) è stato scoperto da un gruppo di ricerca guidato dal neurobiologo Prof. dott. Hilmar Bading dell'Università di Heidelberg. In esperimenti congiunti con ricercatori dell'Università di Shandong (Cina), il team, usando topi modello di MA, ha dimostrato che un complesso neurotossico proteina-proteina è responsabile della morte delle cellule nervose nel cervello e del conseguente declino cognitivo. Secondo gli scienziati, questa scoperta apre nuove prospettive per lo sviluppo di trattamenti efficaci.
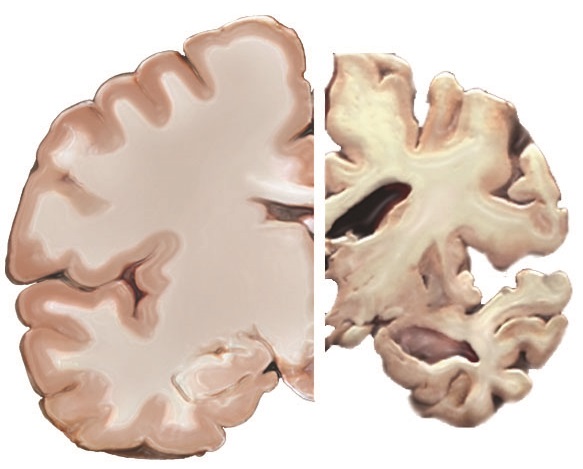
Il complesso proteina-proteina, noto da studi precedenti, è costituito dal recettore NMDA e dal canale ionico TRPM4. I recettori NMDA, che prendono parte alla trasmissione del segnale tra le cellule nervose, si trovano sulla superficie delle cellule e sono presenti sia nelle sinapsi che all'esterno di questi punti di contatto tra le cellule nervose. Sono attivati da un messaggero biochimico, il neurotrasmettitore glutammato.
Mentre l'attivazione dei recettori sinaptici NMDA nel cervello è fondamentale per la sopravvivenza delle cellule nervose e per la conservazione delle capacità cognitive, il TRPM4 fornisce proprietà tossiche ai recettori NMDA extrasinaptici. Insieme costituiscono un 'complesso mortale' che può causare danni e morte alle cellule nervose, spiega Hilmar Bading, che dirige l'Istituto di Neurobiologia al Centro Interdisciplinare Neuroscienze (IZN) dell'Università di Heidelberg.
La ricerca mostra che il complesso neurotossico NMDAR/TRPM4 è presente a livelli molto più alti nei topi di MA rispetto agli animali sani. Usando il nuovo composto farmaceutico FP802, un cosiddetto 'inibitore dell'interfaccia TwinF' scoperto negli studi precedenti dal Prof. Bading e dal suo team dell'IZN, il team di ricerca internazionale ha dimostrato che il complesso NMDAR/TRPM4 ha un ruolo chiave nella progressione del declino cognitivo.
In esperimenti su topi modello, sono riusciti a separare il complesso mortale proteina-proteina usando questa molecola neuroprotettiva. L'FP802 si lega alla cosiddetta superficie di contatto 'TwinF' attraverso la quale il TRPM4 interagisce con i recettori NMDA, bloccando così l'interazione fisica tra le due proteine e dissolvendo il complesso.
"Nei topi di MA trattati con la molecola, la progressione della malattia si è notevolmente rallentata", afferma il dott. Jing Yan, ricercatore nel team del Prof. Bading che ora lavora alla Fundamental Pharma, una emanazione biotecnologica dell'IZN. Cambiamenti cellulari tipici dovuti al MA - che comprendono la perdita di sinapsi e il danno strutturale e funzionale ai mitocondri, le centrali energetiche della cellula - si sono sviluppati solo in misura limitata o per niente, riferiscono gli scienziati. Abilità cognitive come l'apprendimento e la memoria sono rimaste in gran parte integre. Inoltre, la formazione caratteristica dei depositi di amiloide-beta nel cervello si è significativamente ridotta.
Secondo il Prof. Bading, questo approccio differisce fondamentalmente dalle precedenti strategie di trattamento del MA. "Invece di puntare la formazione o la rimozione di amiloide dal cervello, stiamo bloccando un meccanismo cellulare a valle, il complesso NMDAR/TRPM4, che può causare la morte delle cellule nervose e, in un ciclo vizioso che promuove la malattia, promuove la formazione di depositi di amiloide", afferma il neurobiologo di Heidelberg.
In studi precedenti, il team è stato in grado di dimostrare effetti neuroprotettivi comparabili dell'inibitore dell'interfaccia TwinF FP802 nei modelli di sclerosi laterale amiotrofica (SLA), dove il complesso NMDAR/TRPM4 ha pure un ruolo. I ricercatori quindi credono di aver trovato nel nuovo inibitore un principio farmacologico potenzialmente ampiamente applicabile che potrebbe rallentare o addirittura fermare la progressione di malattie neurodegenerative come il MA e la SLA.
Il Prof. Bading avverte, tuttavia, che un'applicazione clinica potenziale è ancora molto lontana: "I risultati precedenti sono abbastanza promettenti nel contesto preclinico, ma sono necessari sviluppi farmacologici completi, esperimenti tossicologici e studi clinici per realizzare una possibile applicazione nell'uomo", sottolinea lo scienziato. In stretta collaborazione con Fondamental Pharma, la molecola neuroprotettiva FP802 deve essere ottimizzata per questo nei prossimi anni.
Fonte: Heidelberg University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: J Yan, [+5], H Bading. The NMDAR/TRPM4 death complex is a major promoter of disease progr... Mol Psychiatry, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV