Lo studio di 3,5 milioni di cellule da oltre 100 cervelli umani ha rilevato che la progressione dell'Alzheimer - ma anche la resilienza alla malattia - dipende dalla stabilità epigenomica.
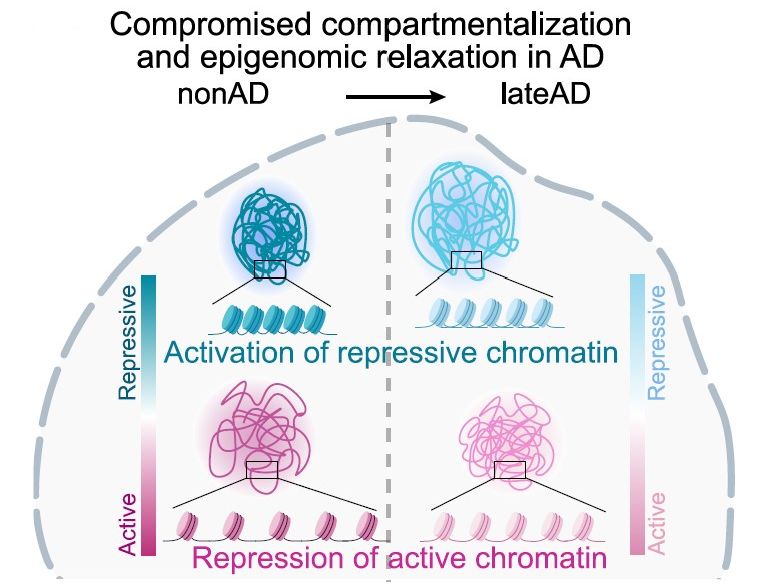 Compartimentazione compromessa: la cromatina che blocca i geni nella salute diventa più aperta nell'Alzheimer, mentre la cromatina che era aperta diventa più bloccata. (Fonte: Z Liu et al / Cell)
Compartimentazione compromessa: la cromatina che blocca i geni nella salute diventa più aperta nell'Alzheimer, mentre la cromatina che era aperta diventa più bloccata. (Fonte: Z Liu et al / Cell)
La maggior parte delle persone riconosce il morbo di Alzheimer (MA) dai suoi sintomi devastanti come la perdita di memoria, mentre i nuovi farmaci colpiscono gli aspetti patologici delle manifestazioni della malattia, come le placche della proteina amiloide. Ora un nuovo ampio studio su Cell di ricercatori del MIT mostra l'importanza di comprendere la malattia come una battaglia sul modo in cui le cellule cerebrali controllano l'espressione dei loro geni. Lo studio dipinge un quadro ad alta risoluzione di una disperata lotta per mantenere un'espressione genica sana e una regolazione genica in cui le conseguenze del fallimento o del successo non sono altro che perdita o conservazione della funzione cellulare e della cognizione.
Lo studio presenta un atlante primo-del-suo-genere e multimodale combinato di espressione e di regolazione genica che abbraccia 3,5 milioni di cellule da sei regioni cerebrali, ottenute profilando 384 campioni di cervelli post mortem da 111 donatori. I ricercatori hanno profilato sia il «trascrittoma», che mostra quali geni sono espressi nell'RNA, che l'«epigenoma», l'insieme di modifiche cromosomiche che stabiliscono quali regioni di DNA sono accessibili e quindi usate dai diversi tipi di cellule.
L'atlante risultante ha rivelato molte intuizioni che dimostrano che la progressione del MA è caratterizzata da due principali tendenze epigenomiche. La prima è che cellule vulnerabili in regioni cruciali del cervello subiscono una rottura dei rigorosi 'compartimenti' nucleari che normalmente mantengono per garantire che alcune parti del genoma siano aperte all'espressione e altre rimangano chiuse. La seconda grande scoperta è che cellule sensibili subiscono una perdita di 'informazioni epigenomiche', perdono la presa sul modello unico di regolazione e espressione genica che dà loro una identità specifica e consente la loro sana funzione.
Molte scoperte specifiche accompagnano l'evidenza di una compartimentazione compromessa e dell'erosione delle informazioni epigenomiche, individuando i circuiti molecolari che si rompono per tipo di cellula, per regione e rete genica. Hanno scoperto, ad esempio, che quando le condizioni epigenomiche si deteriorano, si apre la porta all'espressione di molti geni associati alla malattia, mentre se le cellule riescono a mantenere in ordine la loro casa epigenomica, possono tenere sotto controllo i geni associati alla malattia. Inoltre, i ricercatori hanno visto chiaramente che quando si verificano i guasti epigenomici le persone perdono la capacità cognitiva, ma quando resta la stabilità epigenomica, così fa anche la cognizione.
"Per comprendere la circuiteria, la logica responsabile dei cambiamenti di espressione genica nel MA, dovevamo comprendere la regolamentazione e il controllo a monte di tutti i cambiamenti che stanno accadendo, ed è lì che arriva l'epigenoma", ha affermato l'autore senior Manolis Kellis, professore nel laboratorio di informatica e intelligenza artificiale del gruppo di biologia computazionale. "Questo è il primo atlante su larga scala, a cellula singola, multi regione, gene-regolatorio, del MA, ottenuto sezionando sistematicamente la dinamica dei programmi epigenomici e trascrittomici attraverso la progressione e la resilienza della malattia".
Fornendo quell'esame dettagliato dei meccanismi epigenomici della progressione del MA, lo studio fornisce l'impronta per delineare nuovi trattamenti di MA che possono colpire i fattori alla base dell'ampia erosione del controllo epigenomico o delle manifestazioni specifiche che influenzano i tipi di cellule chiave come i neuroni e le cellule gliali di supporto.
"La chiave per sviluppare nuovi ed efficaci trattamenti per il MA dipende dalla nostra comprensione dei meccanismi che contribuiscono ai guasti della funzione cellulare e della rete nel cervello", ha affermato Li-Huei Tsai, prof.ssa e direttrice del Picower, fondatrice dell'Aging Brain Initiative del MIT insieme a Kellis, nonché coautrice senior dello studio. "Questi nuovi dati migliorano la nostra comprensione dei fattori epigenomici che guidano la malattia".
[...]
Fonte: Picower Institute at MIT (> English) - Traduzione di Franco Pellizzari.
Riferimenti: Z Liu, [+29], Li-Huei Tsai, M Kellis. Single-cell multiregion epigenomic rewiring in Alzheimer’s disease progression and cognitive resilience. Cell, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.













 Associazione Alzheimer OdV
Associazione Alzheimer OdV