Una proteina tossica forma pori dinamici nelle membrane delle cellule cerebrali, e questa può essere la chiave per capire come si sviluppa il Parkinson. Questa è la conclusione di un nuovo studio svolto alla Aarhus University (Danimarca), in cui i ricercatori hanno sviluppato un metodo avanzato per tracciare gli attacchi molecolari in tempo reale.
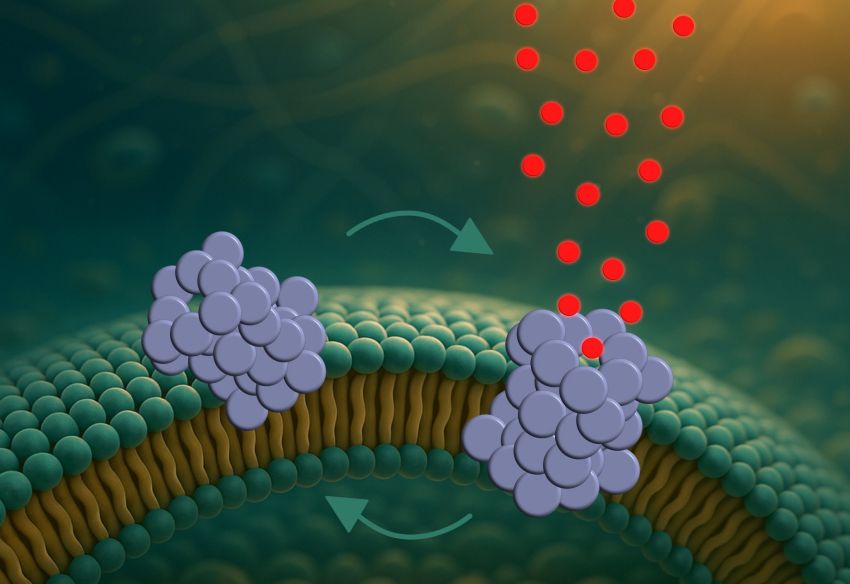 A sinistra un oligomero α-sinucleina (blu) parzialmente inserito in una membrana cellulare. Nel tempo, forma un poro (a destra) che consente a delle molecole di passare per un breve periodo. L'oligomero ritorna quindi nella fase iniziale e scambia dinamicamente i due stati. Foto: Mette Galsgaard Malle
A sinistra un oligomero α-sinucleina (blu) parzialmente inserito in una membrana cellulare. Nel tempo, forma un poro (a destra) che consente a delle molecole di passare per un breve periodo. L'oligomero ritorna quindi nella fase iniziale e scambia dinamicamente i due stati. Foto: Mette Galsgaard Malle
Il morbo di Parkinson (MP) spesso inizia subdolamente: un leggero tremore nella mano, un po' di rigidità. Ma nel tempo, le cellule cerebrali iniziano a morire e i sintomi peggiorano. La causa è rimasta finora un mistero, ma gli scienziati possono ora aver fatto un passo avanti per capirla. Al centro dell'attenzione si trova la proteina α-sinucleina, che ha un ruolo nella comunicazione tra le cellule nel cervello sano. Nel MP, tuttavia, inizia a comportarsi in modo anomalo e si raggruppa in strutture tossiche.
Fino ad ora, la maggior parte delle ricerche si è concentrata sui grandi aggregati noti come fibrille, che sono visibili nei tessuti cerebrali dei pazienti con MP. Ma un nuovo studio si è concentrato su strutture più piccole, meno comprese e più tossiche: oligomeri di α-sinucleina. Secondo lo studio, pubblicato su ACS Nano, questi ultimi producono fori microscopici sulle membrane delle cellule nervose.
Minuscole porte girevoli nelle cellule
"Siamo i primi a osservare direttamente come questi oligomeri formano i pori e come si comportano i pori", afferma Mette Galsgaard Malle, ricercatrice postdottorato delle università di Aarhus e di Harvard.
Il processo si svolge in tre fasi. Prima gli oligomeri si attaccano alla membrana, specialmente nelle regioni curve. Poi si inseriscono parzialmente nella membrana. Infine, formano un poro che consente alle molecole di passare attraverso e potenzialmente interrompere l'equilibrio interno della cellula. Ma questi non sono buchi statici. I pori si aprono e si chiudono costantemente come minuscole porte girevoli.
"Questo comportamento dinamico può aiutare a spiegare perché le cellule non muoiono immediatamente", afferma Bo Volf Brøchner PhD, il primo autore dello studio. "Se i pori rimanessero aperti, le cellule probabilmente collasserebbero molto rapidamente. Ma poiché si aprono e si chiudono, le pompe proprie della cellula potrebbero essere in grado di compensare temporaneamente".
Film molecolare al rallentatore
Questa è la prima volta che sono state osservate queste dinamiche dei pori in tempo reale, grazie a una piattaforma di analisi a singola vescicola sviluppata di recente che consente ai ricercatori di seguire le interazioni tra singole proteine e singole vescicole. Le vescicole sono piccole bolle artificiali che imitano le membrane cellulari e fungono da modelli semplificati di cellule reali.
"È come guardare un film molecolare al rallentatore", spiega Mette Galsgaard Malle. "Non solo possiamo vedere cosa succede, possiamo anche testare come diverse molecole influenzano il processo. Ciò rende la piattaforma uno strumento prezioso per selezionare farmaci".
Lunga strada per il trattamento
In effetti, il team ha già testato nanocorpi - frammenti di piccoli anticorpi - sviluppati per legarsi specificamente a questi oligomeri. Si dimostrano promettenti come strumenti diagnostici altamente selettivi. Tuttavia, come trattamento, c'è ancora lavoro da fare.
"I nanocorpi non sono riusciti a bloccare la formazione dei pori", afferma Bo Volf Brøchner. "Ma possono comunque aiutare a rilevare gli oligomeri nelle fasi molto precoci della malattia. È cruciale, poiché il MP viene in genere diagnosticato solo dopo danni neuronali significativi".
Lo studio mostra anche che i pori non si formano in modo casuale. Tendono a emergere in tipi specifici di membrana, in particolare quelli che assomigliano alle membrane dei mitocondri, le centrali energetiche della cellula. Ciò potrebbe indicare che il danno inizia lì.
Un passo alla volta
Tuttavia, i ricercatori sottolineano che lo studio è stato condotto in sistemi modello, non in cellule vive. Il prossimo passo sarà replicare i risultati nel tessuto biologico, dove entrano in gioco fattori più complessi. "Abbiamo creato una configurazione sperimentale pulita in cui possiamo misurare una cosa alla volta. Questa è la forza di questa piattaforma", afferma Mette Galsgaard Malle. "Ma ora dobbiamo fare il passo successivo e indagare su ciò che accade nei sistemi biologici più complessi".
Fonte: Aarhus University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: B Volf Brøchner, [+4], M Galsgaard Malle. Single-vesicle Tracking of α-Synuclein Oligomers Reveals Pore ... ACS Nano, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.











 Associazione Alzheimer OdV
Associazione Alzheimer OdV