Il morbo di Alzheimer (MA) è probabilmente causato dall'elaborazione bloccata delle proteine nel cervello, secondo un nuovo studio.
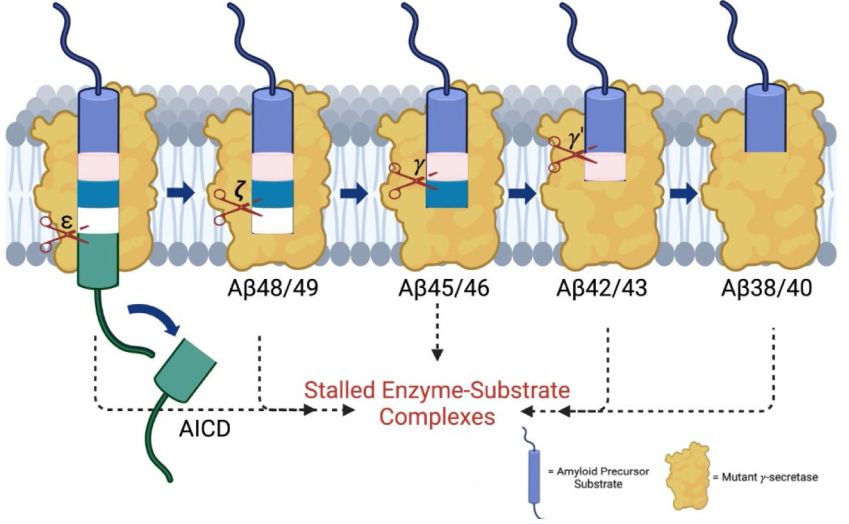 I complessi γ-secretasi PSEN1-mutante del MA familiare sono carenti in fasi specifiche di scissione. I complessi intermedi enzima-substrato sono bloccati in queste fasi. (Fonte: Arafi et al / eLife)
I complessi γ-secretasi PSEN1-mutante del MA familiare sono carenti in fasi specifiche di scissione. I complessi intermedi enzima-substrato sono bloccati in queste fasi. (Fonte: Arafi et al / eLife)
La ricerca, pubblicata su eLife, fornisce approfondimenti importanti su come le mutazioni nel gene presenilin-1 (PSEN1) influiscono sull'elaborazione della proteina precursore amiloide (APP) che, una volta elaborata in proteina amiloide-beta (Aβ) - si accumula nel cervello delle persone con MA. I ricercatori che studiano il MA lavorano da diversi decenni per comprendere la 'ipotesi cascata amiloide', che postula che un accumulo di proteine Aβ avvia una cascata di eventi che portano alla neurodegenerazione e alla demenza.
"Nonostante i progressi nella comprensione delle mutazioni che portano all'aggregazione di Aβ, rimangono incertezze sull'assemblaggio delle proteine neurotossiche di Aβ", afferma la prima autrice Parnian Arafi, ricercatrice dell'Università del Kansas in USA. "Inoltre, gli studi clinici sui trattamenti che puntano la proteina Aβ o i suoi aggregati hanno avuto una efficacia molto modesta, spingendo a mettere in discussione l'Aβ come causa principale del processo patologico del MA".
C'è maggiore attenzione ora alla produzione di Aβ, un processo chiamato proteolisi, durante il quale la 'proteina precursore amiloide' (APP) viene tagliata da un enzima chiamato gamma-secretasi (γ-secretasi). L'autore senior Michael Wolfe, professore di chimica medica all'Università del Kansas e i colleghi avevano in precedenza dimostrato che le mutazioni presenti nel MA familiare ad esordio precoce (MAF) impediscono alla γ-secretasi di tagliare efficacemente l'APP, portando all'accumulo di lunghe forme di intermedi di APP/Aβ.
Inoltre, in vermi modello di MAF, hanno dimostrato che questi complessi γ-secretasi bloccati portano alla neurodegenerazione, anche quando l'Aβ non è presente. Nel presente studio, il team ha ampliato l'analisi a altre 6 mutazioni presenti nel MAF a esordio precoce, misurando l'impatto di ciascuna di esse su ogni fase della produzione di Aβ. Queste sono mutazioni che vengono esplorate dal Dominantly Inherited Alzheimer Network (DIAN), perché causano lo sviluppo di MA tra i 27 e i 58 anni di età.
Per esplorare l'effetto delle mutazioni, hanno generato e purificato proteine mutanti γ-secretasi e quindi le hanno incubate con un frammento di APP. Ciò ha permesso loro di determinare come la γ-secretasi mutante ha tagliato l'APP, misurando con la spettrometria di massa i frammenti proteici risultanti.
Hanno scoperto che tutte le mutazioni γ-secretasi testate hanno causato carenze in diverse fasi di elaborazione dell'APP, la cui natura variava a seconda della mutazione specifica. Misurando i diversi prodotti generati da ciascuna mutazione, il team ha rivelato quantitativamente come ciascuna di esse influenza specificamente la produzione di diverse proteine intermedie APP/Aβ.
Durante la proteolisi, l'enzima γ-secretasi si unisce inizialmente in un complesso con APP e quindi con successive forme intermedie della proteina mentre viene tagliata. Per testare gli effetti delle mutazioni sulla stabilità di questi complessi enzima-substrato, il team ha usato una coppia di anticorpi marcati in modo fluorescente che puntano il frammento di APP e l'enzima.
Una riduzione di fluorescenza indica quando l'enzima e il substrato sono in prossimità, cioè legati insieme. Per tutti i mutanti testati, il segnale fluorescente si è ridotto rispetto all'enzima funzionale normale, indicando che queste mutazioni aumentano la stabilità dei complessi enzima-substrato. Questo risultato ha senso a fianco dell'analisi iniziale della proteolisi, il che suggerisce che il processo proteolitico si è bloccato.
"Abbiamo dimostrato che queste mutazioni portano a proteolisi bloccata e stabilizzano l'enzima con il suo substrato in forma intermedia", afferma la Arafi. "Questi risultati sono in linea con la nostra ipotesi del 'complesso bloccato', per cui sono questi complessi enzima-substrato che innescano la neurodegenerazione anche in assenza di produzione di Aβ".
"Le difficoltà a individuare le guide del MA e a scoprire terapie efficaci suggeriscono che nella neurodegenerazione potrebbero avere ruoli fondamentali entità e processi oltre l'Aβ", afferma Wolfe. "Concentrandoci sul MA familiare, abbiamo semplificato l'identificazione di meccanismi patogeni, aprendo le porte allo sviluppo di nuovi trattamenti. Proponiamo che attivatori della γ-secretasi, idonei a recuperare la proteolisi bloccata, possano integrare i trattamenti che puntano altri percorsi associati al MA".
Fonte: eLife (> English) - Traduzione di Franco Pellizzari.
Riferimenti: P Arafi, [+2], MS Wolfe. Alzheimer-mutant γ-secretase complexes stall amyloid β-peptide production. eLife, 2024, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.









 Associazione Alzheimer OdV
Associazione Alzheimer OdV