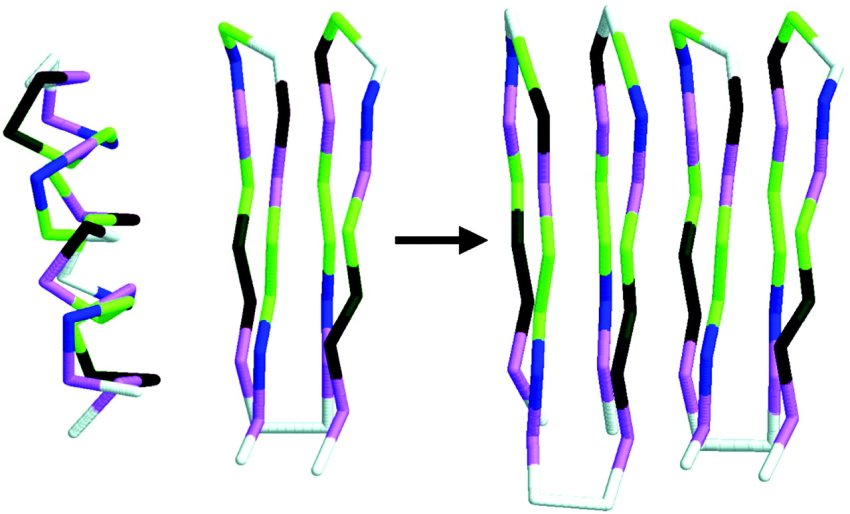
 Un modello di propagazione delle malattie da prioni. La forma corretta (elicoidale) di una proteina si ripiega erroneamente in una struttura a β in presenza della forma mal ripiegata della struttura β rigida. (Fonte: Edyta Małolepsza et al.)
Un modello di propagazione delle malattie da prioni. La forma corretta (elicoidale) di una proteina si ripiega erroneamente in una struttura a β in presenza della forma mal ripiegata della struttura β rigida. (Fonte: Edyta Małolepsza et al.)
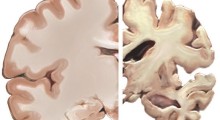
I prioni, una classe di proteine mal ripiegate, hanno la tendenza a formare aggregati infettivi, causando malattie neurodegenerative mortali negli esseri umani (come l'Alzheimer). In un nuovo studio, scienziati del Tokyo Institute of Technology (Tokyo Tech) e della Kanazawa University hanno usato la microscopia a forza atomica ad alta velocità per scoprire le proprietà strutturali e dinamiche dei prioni nel lievito. I loro risultati potrebbero portare a una migliore comprensione dei prioni in generale, compresi i prioni mammiferi che causano malattie.
I prioni sono una classe di proteine mal ripiegate che formano aggregati chiamati 'fibrille amiloidi'. Questi aggregati sono il colpevole principale dietro gravi malattie neurodegenerative dei mammiferi, come l'Alzheimer. Ciò che li rende così mortali è che sono in grado di trasmettere la loro conformazione erronea a proteine altrimenti sane, causando uno squilibrio nella funzione cellulare.
Attualmente, non ci sono trattamenti efficaci per le malattie mortali da prioni, soprattutto perché lo studio dei prioni mammiferi è difficile. Così, gli scienziati si sono rivolti allo studio dei prioni negli organismi meno complessi come il lievito, che ci potrebbe dare una visione più chiara sui prioni mammiferi. Anche i prioni del lievito, come la proteina Sup35NM, sono noti per formare fibrille amiloidi.
Ma il processo con cui singole molecole Sup35NM (dette monomeri) si combinano per formare fibrille amiloidi non è ancora compreso. Inoltre, i monomeri Sup35NM talvolta formano strutture più piccole chiamate oligomeri, altro processo tuttora poco chiaro. Per fare luce sulle malattie legate ai prioni, è fondamentale capire i dettagli esatti con cui i prioni formano le fibrille amiloidi.
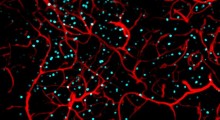
Con un nuovo studio pubblicato su PNAS, i ricercatori del Tokyo Institute of Technology e dell'Università di Kanazawa, guidati dal prof. Hideki Taguchi, hanno cercato di scavare più a fondo nelle strutture da prioni e nei loro meccanismi. Hanno usato una tecnica moderna di microscopia, chiamata microscopia a forza atomica ad alta velocità (AFM-HS, high-speed atomic force microscopy), sviluppata dal dott. Toshio Ando della Kanazawa University, per osservare la formazione di fibrille amiloidi Sup35NM in tempo reale.
Il prof. Taguchi spiega: "Studi precedenti hanno usato metodi che non consentivano la valutazione simultanea ad alta risoluzione delle strutture e delle dinamiche coinvolte nella oligomerizzazione e nella fibrillazione della Sup35NM. Per superare questa limitazione, abbiamo usato l'HS-AFM, che permette la visualizzazione diretta di molecole proteiche in azione dinamica ad alta risoluzione".
Per cominciare, i ricercatori hanno analizzato monomeri Sup35NM usando l'HS-AFM. La loro analisi ha rivelato che le molecole Sup35NM contenevano una struttura globulare con due strutture altamente flessibili simili a code. E poi, hanno osservato le forme oligomeriche di Sup35NM, monomeri incubati in una soluzione denaturante in condizioni controllate, che, in poche ore, hanno portato alla formazione di oligomeri.
Ulteriori analisi con HS-AFM hanno rivelato l'esatta dimensione di questi oligomeri, un massimo di 3-4 nm, che non aumenta. Così, gli scienziati hanno dedotto che queste dimensioni potrebbero essere una proprietà intrinseca degli oligomeri in queste condizioni.
I ricercatori sono poi passati a studiare le forme fibrillari di Sup35NM. Al contrario degli oligomeri, le fibrille hanno richiesto un tempo di incubazione molto più lungo per formarsi, da 2 a 3 giorni. Inoltre, i ricercatori hanno osservato che la fibrilla si è allungata uniformemente senza l'appendice degli oligomeri. Questi risultati indicavano che gli oligomeri Sup35NM non sono un prerequisito per la formazione di fibrille amiloidi, portando gli scienziati a concludere che gli oligomeri potrebbero in realtà avere funzioni cellulari che sono diverse da quelle delle Sup35NM.
Infine, i ricercatori hanno studiato un fenomeno interessante in cui le strutture oligomeri e fibrillari sembrano mantenere una distanza interspaziale o "distanza". Essi hanno osservato che il tronco delle fibrille ha una struttura rigida che respinge gli oligomeri provenienti dai lati. Nel frattempo, la distanza tra la punta delle fibrille e gli oligomeri vicini è meno pronunciata perché la punta non ha tali strutture rigide. Questo ha aiutato gli scienziati a capire il motivo per cui le fibrille amiloidi Sup35NM si sviluppano sempre in linea retta, senza formare rami.
In sintesi, questi risultati forniscono un resoconto dettagliato sulle caratteristiche strutturali e funzionali dei prioni del lievito, nelle forme monomeriche, oligomeriche e fibrillari. "Le nostre osservazioni con HS-AFM delle Sup35NM hanno svelato le caratteristiche delle dinamiche Sup35NM, permettendo di approfondire la meccanica nella formazione delle fibrille amiloidi", conclude il prof Taguchi.
Questa nuova comprensione della struttura e del meccanismo dei prioni può dare speranza per terapie efficaci contro le malattie neurodegenerative negli esseri umani? Solo il tempo lo dirà, ma questo studio fa sicuramente un enorme passo in avanti verso quella direzione.
Fonte: Tokyo Institute of Technology (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Hiroki Konno, Takahiro Watanabe-Nakayama, Takayuki Uchihashi, Momoko Okuda, Liwen Zhu, Noriyuki Kodera, Yousuke Kikuchi, Toshio Ando, Hideki Taguchi. Dynamics of oligomer and amyloid fibril formation by yeast prion Sup35 observed by high-speed atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America, 2020, DOI
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer onlus di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.







 Associazione Alzheimer OdV
Associazione Alzheimer OdV