I dettagli della rimozione dei componenti cellulari dannosi spiegano perché le mutazioni genetiche portano a malattie neurodegenerative.
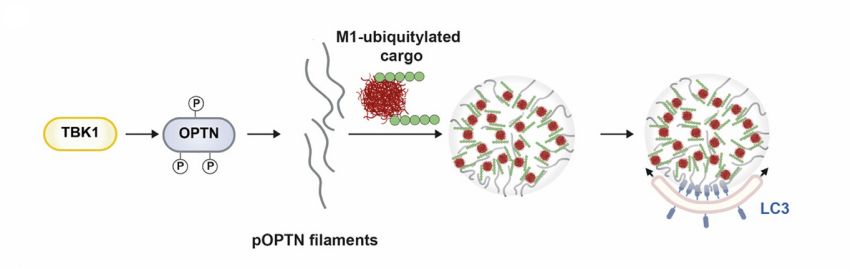 La fosforilazione di Optineurina da parte di TBK1 induce la formazione di filamenti che si condensano dopo il legame con la poliubiquitina lineare (Fonte: Herrera et al /AdvSci)
La fosforilazione di Optineurina da parte di TBK1 induce la formazione di filamenti che si condensano dopo il legame con la poliubiquitina lineare (Fonte: Herrera et al /AdvSci)
Gli aggregati di proteine, gli organelli danneggiati e i batteri invasori vengono identificati e rimossi nelle cellule sane. Un gruppo di ricerca internazionale guidato dalla prof.ssa Konstanze F. Winklhofer dell'Istituto di biochimica e patobiochimica dell'Università della Ruhr di Bochum (Germania), ha decifrato un meccanismo critico alla base di questi processi, concentrandosi sulla proteina optineurina.
Malfunzionamenti di questa proteina possono portare a malattie neurodegenerative come la sclerosi laterale amiotrofica o la demenza frontotemporale. I ricercatori sperano che le loro intuizioni, pubblicate su Advanced Science, portino a nuovi approcci di trattamento in futuro.
Marcatura e rimozione di sostanze nocive
Tutte le cellule viventi devono monitorare costantemente i propri componenti ed eliminare quelli potenzialmente dannosi, come proteine mal ripiegate o microbi invasori, quando necessario. Questo processo è chiamato autofagia selettiva. Per garantire che vengano eliminati solo i componenti cellulari corretti, questi sono contrassegnati con catene di molecole di ubiquitina, che interagiscono con i recettori selettivi dell'autofagia che si legano anche ai meccanismi dell'autofagia.
“Una proteina fondamentale in questa logistica cellulare è l’optineurina”, spiega la Winklhofer, “che identifica specificamente le proteine mal ripiegate, i mitocondri danneggiati e i batteri invasori, e segnala al sistema autofagico che questi fattori di disturbo devono essere rimossi”.
Finora non era chiaro come funzionasse nel dettaglio questo processo di identificazione e organizzazione.
Come si forma il collegamento con il macchinario di demolizione
Il gruppo di ricerca di Bochum ha dimostrato che, dopo essersi legata alle catene dell'ubiquitina, l'optineurina forma dei condensati che facilitano il collegamento efficiente al meccanismo dell'autofagia. I condensati sono spazi di reazione nelle cellule che si formano attraverso la separazione di fase. La formazione di condensati optineurina-ubiquitina richiede la fosforilazione dell'optineurina da parte della proteina TBK1 (tank-binding kinase 1), poiché l'optineurina fosforilata può legarsi meglio alle catene dell'ubiquitina.
Nei condensati si arricchisce anche la proteina LC3, che ha un ruolo importante nel processo di autofagia. Attraverso il legame dell'optineurina con la LC3, i componenti da scomporre vengono diretti precisamente verso le membrane, dove vengono impacchettati negli autofagosomi e possono quindi essere digeriti negli organelli lisosomiali.
Le proteine perdono la loro funzione attraverso le mutazioni
"È interessante che le mutazioni nei geni optineurina e TBK1 sono associate a forme familiari di malattie neurodegenerative", afferma la dott.ssa Georgina Herrera, prima autrice della pubblicazione. "Queste mutazioni patogene portano a una perdita di funzione nell'optineurina e nella TBK1. Gli aggregati proteici possono quindi accumularsi nelle cellule nervose".
“Lo studio attuale fornisce una visione meccanicistica di questi processi”, afferma la Winklhofer. “Una comprensione dettagliata della scomposizione e dell’eliminazione dei componenti cellulari dannosi potrebbe ispirare nuovi approcci terapeutici in futuro, in particolare per le malattie neurodegenerative”.
Fonte: Ruhr-University Bochum (> English) - Traduzione di Franco Pellizzari.
Riferimenti: MG Herrera, [+9], KF Winklhofer. TBK1 Induces the Formation of Optineurin Filaments That Condensate with Polyubiquitin and LC3 for Cargo Sequestration. Adv Sci, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.















 Associazione Alzheimer OdV
Associazione Alzheimer OdV