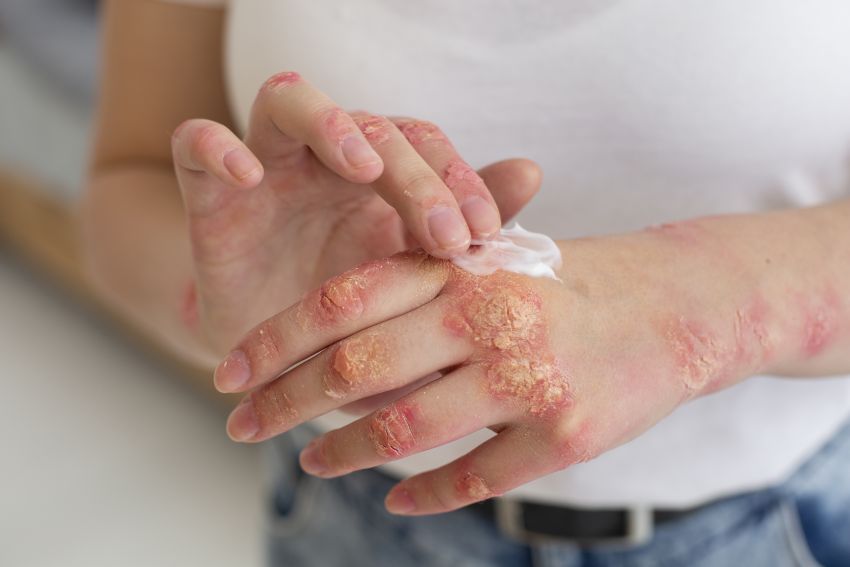
 L'eczema è legato al fungo micobioma cutaneo Malassezia (Image by freepik)
L'eczema è legato al fungo micobioma cutaneo Malassezia (Image by freepik)
'Microbioma intestinale' è diventato un termine sanitario popolare negli ultimi anni. È facile capire perché, viste le numerose ricerche che dimostrano quanto siano importanti per la salute i trilioni di microbi che vivono nel nostro intestino. Ma ciò che molte persone potrebbero non capire è che il microbioma non contiene solo batteri. Contiene anche altri tipi di microbi, compresi funghi. La componente fungina del microbioma è chiamata 'micobioma'.
Sebbene il micobioma sia stato studiato meno bene della sua controparte batterica, ricerche recenti mostrano che è sensibile alla dieta e può influire anche sulla nostra salute. Il micobioma meglio studiato è quello del nostro intestino: è composto da molte specie fungine, e quelle più diffuse lì, soprattutto nel mondo occidentale, appartengono alla famiglia della Candida.
La Candida è un tipo di lievito. Per la maggior parte di noi, la popolazione di Candida nel micobioma è tenuta sotto controllo dal sistema immunitario e dai batteri intestinali. Ma i cambiamenti a uno di questi due possono causare l’espansione delle popolazioni di Candida nel micobioma. Questo può essere un problema, perché la Candida può causare infezioni potenzialmente letali nelle persone con un sistema immunitario danneggiato.
Ad esempio, la ricerca ha scoperto che i pazienti ospedalieri a cui vengono somministrati antibiotici hanno maggiori probabilità di sviluppare infezioni da Candida. Ciò in parte si spiega con l’effetto degli antibiotici, che uccidono alcune specie di batteri intestinali che competono con la Candida per lo spazio e le risorse all’interno dell’intestino. Si è anche scoperto che gli antibiotici alterano direttamente le nostre cellule immunitarie e il modo in cui combattono le infezioni fungine.
Un altro studio, che ha analizzato il micobioma dei malati di cancro, ha scoperto che coloro che avevano sviluppato infezioni gravi da Candida avevano una crescita eccessiva del fungo nel micobioma appena prima dell’inizio dell’infezione. Combinato con gli effetti dannosi della chemioterapia sul sistema immunitario, ciò ha reso più difficile per i pazienti combattere l’infezione. L’interruzione dell’equilibrio della Candida nel micobioma è stata collegata anche a molte altre malattie. Ad esempio, i livelli di Candida sono elevati nei pazienti criticamente ammalati. Ciò suggerisce che troppa Candida nel nostro intestino è un segno di cattiva salute.
I cambiamenti nel micobioma fungino sono stati collegati anche a diverse malattie intestinali, inclusa la malattia infiammatoria intestinale. Anche la ricerca sulla malattia di Crohn ha dimostrato che i pazienti presentano una crescita eccessiva di Candida. Questi funghi producono anche tossine che irritano il rivestimento intestinale, il che potrebbe potenzialmente spiegare alcuni dei sintomi riscontrati dai pazienti affetti da Crohn. Alti livelli di Candida nell’intestino possono attivare anche le cellule immunitarie, rendendole più infiammatorie. Ciò è stato osservato in pazienti con COVID-19 grave.
Micobiomi nel corpo
Il micobioma non si trova solo nel nostro intestino. Abbiamo anche un micobioma cutaneo. In effetti, la pelle tra le dita dei piedi contiene un numero di specie fungine più diversificato di qualsiasi altro micobioma cutaneo. Il micobioma cutaneo è per lo più dominato da un fungo chiamato Malassezia, un lievito che si è adattato a crescere sulla superficie della pelle. La Malassezia può attivare le cellule immunitarie che risiedono tra gli strati della pelle, portando a possibili infiammazioni legate a disturbi della pelle, come la psoriasi e l’eczema.
Anche la Candida auris è motivo di preoccupazione. Questo fungo è resistente a molti farmaci antifungini, motivo per cui può rappresentare un problema se cresce sulla superficie della pelle. In un ospedale o al pronto soccorso, ciò potrebbe essere pericoloso, in particolare per i pazienti che hanno problemi di sistema immunitario. Le donne hanno anche un micobioma all'interno della vagina. Il suo equilibrio con le comunità batteriche che vivono lì può essere un grande determinante della salute vaginale.
Una delle infezioni fungine più comuni a livello globale è la candidosi vaginale (mughetto), che può causare sintomi come prurito intenso, dolore e gonfiore. Molte donne adulte sperimentano almeno un’infezione da mughetto nel corso della loro vita. La fonte del mughetto è un altro fungo della famiglia della Candida: la Candida albicans, un membro comune del micobioma vaginale.
Il microbioma della vagina di norma è dominato dai batteri Lactobacillus che aiutano a tenere sotto controllo le popolazioni di Candida. Ma se l’equilibrio tra batteri e funghi viene rotto (ad esempio a causa degli antibiotici), il fungo può crescere troppo o produrre molecole infiammatorie all’interno della vagina. Questa risposta infiammatoria è responsabile dei sintomi comuni del mughetto, come arrossamento e prurito.
I probiotici possono aiutare a ripristinare l’equilibrio tra funghi e batteri per prevenire le infezioni vaginali da lieviti, anche se finora hanno avuto un successo limitato. Alcuni nuovi trattamenti che puntano le molecole fungine che causano l’infiammazione si sono mostrati promettenti in modelli animali e in un piccolo numero di donne.
Ci sono buone prove che suggeriscono che potremmo avere un micobioma anche nei polmoni e nel latte materno. In modo controverso, alcuni hanno addirittura suggerito che potremmo avere un piccolo numero di cellule fungine nel cervello – e queste cellule fungine potrebbero essere collegate a disturbi neurodegenerativi come il Parkinson e l’Alzheimer. Studi autoptici hanno trovato tracce di funghi nel cervello di persone morte per disturbi cerebrali, ma ciò non prova che i funghi abbiano causato la loro malattia o che fossero presenti durante la loro vita.
Studi sperimentali sui topi hanno anche dimostrato che un piccolo numero di cellule fungine può sopravvivere nel cervello per lunghi periodi di tempo, e la presenza di queste cellule fungine è stata collegata a una funzione ridotta della memoria. Esperimenti sui moscerini hanno anche dimostrato che i funghi possono viaggiare fino al cervello e influenzarne la funzione. Questa è la prova migliore che abbiamo attualmente che mostra che un piccolo numero di funghi può entrare nel cervello e sopravvivere a lungo termine. Resta da dimostrare se ciò si verifichi negli esseri umani e se possa essere considerato un vero micobioma.
C’è ancora molto che non sappiamo sul micobioma. Ma con la ricerca che continua in quest’area potremmo presto comprendere meglio l’importanza del micobioma per la nostra salute e come possiamo coltivarlo e prendercene cura.
Fonte: Rebecca A. Drummond (prof.ssa di Immunologia e Immunoterapia, Università di Birmingham) in The Conversation (> English) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.














 Associazione Alzheimer OdV
Associazione Alzheimer OdV