
Ieri sera mentre si avvicinava il tramonto, ho guardato fuori da una finestra sul lato ovest della nostra casa e ho visto un sorprendente riflesso senza testa che mi guardava a sua volta. L'ottica si può spiegare facilmente: ero in piedi illuminato dalla luce del sole splendente davanti a me, la stanza dietro di me era buia e l'erba della spiaggia di fronte a me era principalmente nell'ombra.
Le mie gambe erano nascoste alla luce solare dal davanzale della finestra, quindi le mie gambe inferiori erano scomparse nell'immagine riflessa. Non sono sicuro di cosa sia successo alla mia testa. Ho afferrato il cellulare per registrare il momento, un momento che stranamente invocava una combinazione soprannaturale di trepidazione ed euforia.
Per quanto riguarda cose più terrene, a marzo 2024 la FDA ha informato il produttore Eli Lilly che la sua domanda di approvazione piena dell'anticorpo monoclonale anti-amiloide donanemab doveva attendere un'ulteriore revisione. Il donanemab è il farmaco più efficace a rimuovere completamente le placche di amiloide-beta dal cervello, ma ha solo un modesto beneficio del 35% nel rallentare la compromissione cognitiva.
La risposta migliore al donanemab l'hanno avuta i soggetti con la malattia più lieve e quelli asintomatici con placche amiloidi nel cervello ma senza compromissione cognitiva. La maggior parte degli esperti di Alzheimer intervistati per un articolo di NeurologyToday rilasciato il 18 aprile 2024 ritengono che il donanemab debba essere approvato, ma hanno convenuto che dovrebbero essere chiariti i dettagli di chi debba e no riceverlo e altri problemi di utilizzo.
Aggiornamento:
Il donenemab è stato approvato dalla FDA il 2 luglio 2024, con nome commerciale Kisunla (la FDA è l'autorità dei farmaci per gli USA).
Invece per l'Europa, il comitato consultivo dell'EMA-Agenzia Europea dei Medicinali ha emesso il 28 marzo 2025 una opinione negativa sulla sua approvazione, ritenendo che i rischi di potenziali eventi fatali siano superiori ai benefici.
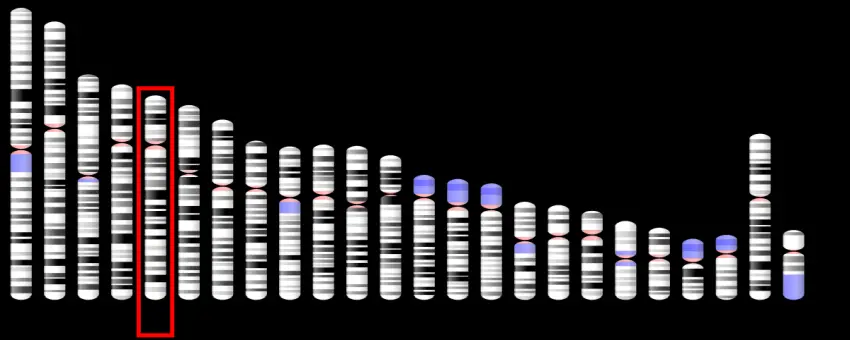
Ad esempio, i portatori dell'allele APOE-4 hanno un rischio maggiore di avere gonfiore sintomatico, a volte fatale, e/o sanguinamento nel cervello quando ricevono il donanemab o farmaci simili. Tutti i portatori dell'APOE-4 dovrebbero essere esclusi dal trattamento? Se non è così, chi pagherà per la sorveglianza aggiunta, come le scansioni di risonanza magnetica frequenti necessarie per i portatori di APOE-4.
Se escludiamo tutti i portatori di APOE-4, escluderemo il 60% delle persone con Alzheimer. Concordo sul fatto che la FDA abbia ragione a mettere in pausa l'approvazione del donanemab prima di aprire quella che potrebbe diventare una scatola di Pandora neurologica. Dobbiamo essere sicuri di farlo bene.
Fonte: Daniel Gibbs in A Tattoo On My Brain (> English) - Traduzione di Franco Pellizzari.
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.














 Associazione Alzheimer OdV
Associazione Alzheimer OdV