 Lo studio ha usato un fibrinogeno umano purificato, raffigurato qui. (Fonte: Lori Chertoff/Rockefeller University)
Lo studio ha usato un fibrinogeno umano purificato, raffigurato qui. (Fonte: Lori Chertoff/Rockefeller University)
Gli scienziati sanno da tempo che il cervello del morbo di Alzheimer (MA) presenta spesso placche e grovigli anormali, e studi recenti hanno evidenziato il ruolo del sistema vascolare del cervello nella progressione della malattia. Ma per decenni, questa conoscenza non è riuscita a tradursi in trattamenti pienamente efficaci. La mancanza di progressi è in gran parte dovuta al fatto che, nonostante i risultati fondamentali, il percorso preciso della neurodegenerazione non è ancora chiaro.
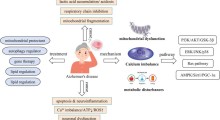
Ora, una nuova ricerca dimostra che quando l’amiloide-beta (Aβ) si lega al fibrinogeno, una delle principali proteine del sangue, forma coaguli anomali resistenti alla degradazione. Questi coaguli sono collegati al danno vascolare e all’infiammazione, e anche piccole quantità di questo complesso sembrano innescare patologie precoci di MA, come la perdita di sinapsi, la neuroinfiammazione e la rottura della barriera emato-encefalica. I risultati rafforzano l’evidenza che le malattie vascolari contribuiscono alla neurodegenerazione e forniscono speranza ai pazienti con MA sotto forma di un nuovo promettente bersaglio farmacologico: i complessi Aβ/fibrinogeno.
"Ci vuole una quantità maggiore di Aβ o fibrinogeno da soli per causare gravi danni al cervello del MA", afferma Erin Norris, prof.ssa associata di ricerca nel laboratorio di Sidney Strickland alla Rockefeller. "Ma quando i due si combinano insieme, bastano solo piccole quantità di ciascuno per causare danni. C'è un effetto sinergico tra Aβ e fibrinogeno".
Aggravare il problema
Il Laboratorio di Neurobiologia e Genetica di Strickland sta studiando il complesso Aβ/fibrinogeno da quasi due decenni. Il lavoro precedente del laboratorio ha dimostrato che l’Aβ lega il fibrinogeno e collega il complesso alla patogenesi del MA. Le loro scoperte hanno suggerito una connessione tra neurodegenerazione e salute vascolare, un’affermazione un tempo controversa che ha guadagnato terreno da quando il laboratorio l’ha proposta anni fa. "Solo di recente, con una serie di scoperte nel campo, le persone hanno iniziato a credere che il sistema vascolare sia coinvolto nella patogenesi del MA", afferma la Norris. “Sin dai nostri risultati iniziali, ci siamo concentrati sullo studio dei meccanismi che spiegano come un sistema vascolare disfunzionale influisce sul MA”.
L’identificazione del complesso Aβ/fibrinogeno è stato un buon inizio. Ma la portata del suo impatto – e se il complesso da solo potesse causare il MA – rimaneva poco chiara. Quindi il team di Strickland ha deciso di formare il complesso a basse concentrazioni in laboratorio e di introdurlo direttamente su fette di tessuto cerebrale di topo e nel cervello di topo vivo. Il loro obiettivo era isolare in dettaglio gli effetti dell’Aβ/fibrinogeno. "Volevamo mostrare davvero il danno, per arrivare esattamente al modo in cui venivano danneggiati i terminali pre e post-sinaptici", afferma la prima autrice Elisa Nicoloso Simões-Pires.
Ciò che hanno scoperto è che, mentre ciascun componente da solo, anche in quantità crescenti, non causava molti danni, la combinazione di bassi livelli di Aβ/fibrinogeno si è rivelata tossica per le sinapsi e ha causato molti dei tratti caratteristici del MA, come la neuroinfiammazione e la rottura della barriera emato-encefalica. Che la colpa fosse del complesso l'hanno confermato usando anticorpi che impedivano all’Aβ di legarsi al fibrinogeno, riducendo gli effetti dannosi.
"Abbiamo dimostrato che il complesso induce effettivamente una perdita della barriera emato-encefalica, quando le proteine da sole non lo fanno", afferma la Simões-Pires. “La rottura della barriera emato-encefalica consente alle proteine del sangue di attraversare il cervello, provocando ulteriori danni”.
Nuovo bersaglio farmacologico
Uno dei punti di forza dello studio è che ha coinvolto sia fettine di cervello che topi vivi. "Si è trattato di un progetto in vitro e in vivo, che hanno fornito entrambi lo stesso risultato", afferma la Norris. “Siamo molto più fiduciosi nei nostri risultati quando possiamo mostrare la stessa cosa in cultura e in un organismo vivente”. Per il seguito, il team intende esplorare il meccanismo: perché questo complesso causa così tanti problemi?
Potrebbero esserci anche implicazioni cliniche, perché lo studio suggerisce che anche piccole quantità del complesso Aβ/fibrinogeno possono innescare le caratteristiche del MA molto prima che compaiano i sintomi cognitivi. I topi esposti al complesso, ad esempio, hanno mostrato anche livelli elevati di fosfo-tau181, un biomarcatore usato negli esseri umani per rilevare il MA anni prima che si manifestino i sintomi. Questo risultato solleva la possibilità che lo studio attuale stia mimando le prime fasi della progressione del MA e che un intervento precoce mirato al complesso stesso possa ritardarlo o prevenirlo.
Sebbene molti meccanismi contribuiscano al MA, il team ritiene che questo particolare percorso meriti maggiore attenzione. “Non è una malattia semplice”, afferma la Simões-Pires. "Molti altri fattori possono indurre neurotossicità, e certamente non proponiamo che l'inibizione di questa formazione complessa possa curare il MA. Ma forse puntare questo complesso allevierebbe alcune patologie e sarebbe ancora più efficace in combinazione con altre terapie".
Fonte: Rockefeller University (> English) - Traduzione di Franco Pellizzari.
Riferimenti: E Nicoloso Simões‐Pires, [+3], EH Norris. Synergistic effects of the Aβ/fibrinogen complex on synaptotoxicity, neuroinflammation, and blood–brain barrier damage in Alzheimer's disease models. Alzheimer's, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.








 Associazione Alzheimer OdV
Associazione Alzheimer OdV