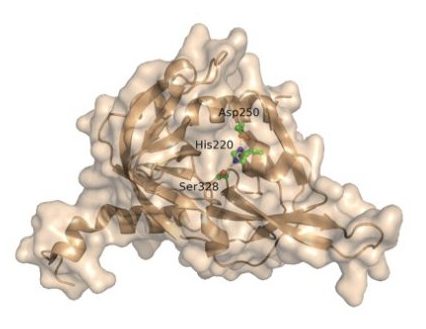
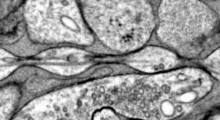
 Gli scienziati del Salk hanno chiarito che l'enzima HtrA1 (nella foto) degrada l'ApoE4, il maggiore fattore di rischio genetico dell'Alzheimer. (Fonte: Salk Institute)Gli scienziati sanno da decenni che le persone con due copie di un gene chiamato «apolipoproteina E4» (ApoE4) hanno una probabilità molto più alta di avere l'Alzheimer a 65 anni, rispetto al resto della popolazione.
Gli scienziati del Salk hanno chiarito che l'enzima HtrA1 (nella foto) degrada l'ApoE4, il maggiore fattore di rischio genetico dell'Alzheimer. (Fonte: Salk Institute)Gli scienziati sanno da decenni che le persone con due copie di un gene chiamato «apolipoproteina E4» (ApoE4) hanno una probabilità molto più alta di avere l'Alzheimer a 65 anni, rispetto al resto della popolazione.
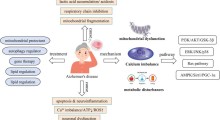
Dei ricercatori del Salk Institute hanno ora identificato un nuovo collegamento tra l'ApoE4 e l'accumulo di proteine associato all'Alzheimer, fornendo una possibile spiegazione biochimica del modo in cui l'ApoE4 extra causa la malattia.
"Il quadro generale è che abbiamo trovato un modo molto diverso di pensare a come potrebbero essere regolate le proteine nell'Alzheimer", dice Alan Saghatelian, professore del Salk.
La scoperta, che appare nel numero di agosto 2016 del Journal of American Chemical Society, sottolinea l'importanza di esaminare geni e proteine che la letteratura non ha associato all'Alzheimer, per progredire nella comprensione della malattia.
L'Alzheimer a tarda insorgenza (il sottoinsieme del disturbo che si verifica dopo i 65 anni) colpisce più di 5 milioni di americani, ed è caratterizzato da una perdita progressiva della memoria e da demenza. Gli scienziati hanno avanzato diverse ipotesi sulle cause, compreso l'accumulo di ammassi proteici chiamati placche di amiloide-beta e grovigli tau nel cervello.
L'apolipoproteina E è disponibile in tre versioni, o varianti, chiamate ApoE2, ApoE3 e ApoE4. Tutte le proteine ApoE hanno la stessa funzione normale: trasportano grassi, colesterolo e vitamine in tutto il corpo, compreso il cervello. Mentre l'ApoE2 è protettivo e l'ApoE3 non sembra avere alcun effetto, una mutazione in ApoE4 è un fattore di rischio genetico ben consolidato dell'Alzheimer ad insorgenza tardiva. Rapporti precedenti avevano suggerito che l'ApoE4 può influenzare il modo in cui il cervello elimina l'amiloide-beta, ma finora non era chiaro ciò che accade a livello molecolare.
"L'ApoE4 è il cambiamento genetico più predittivo dell'Alzheimer ad insorgenza tardiva, ma nessuno ha veramente capito quello che succede a livello molecolare", spiega Saghatelian. Gli scienziati avevano però scoperto degli indizi in precedenza: che l'ApoE4 potrebbe degradare in modo diverso dalle altre varianti, ma non si sapeva quale proteina eseguisse questa scomposizione dell'ApoE4.
Per trovare la proteina responsabile della degradazione dell'ApoE4, Saghatelian e il ricercatore associato Qian Chu, primo autore della nuova ricerca, hanno cercato tra i tessuti il potenziale sospetto e sono arrivati a un enzima chiamato «peptidasi serina A1 richiedente alta temperatura» (high-temperature requirement serine peptidase A1 - HtrA1).
Quando hanno confrontato il modo dell'HtrA1 di degradare l'ApoE4 con quello dell'ApoE3, hanno scoperto che l'enzima elabora l'ApoE4 più dell'ApoE3, masticando l'ApoE4 in frammenti più piccoli e meno stabili. I ricercatori hanno confermato l'osservazione sia in proteine isolate che in cellule umane. La scoperta suggerisce che le persone con ApoE4 potrebbero avere meno ApoE generale nelle cellule cerebrali, e una quantità maggiore di prodotti di degradazione della proteina.
"L'idea che gira è che i prodotti di degradazione dell'ApoE4 potrebbero essere tossici", ha detto Saghatelian. "Ora, conoscendo l'enzima che li scinde, abbiamo un modo per testare in realtà questa idea".
Ma non è solo una mancanza di ApoE a piena lunghezza, o un aumento dei suoi frammenti, che possono causare l'Alzheimer nelle persone con ApoE4. Saghatelian e Chu hanno anche scoperto che l'ApoE4 (legandosi così bene all'HtrA1) impedisce all'enzima da abbattere la proteina tau, responsabile dei grovigli tau associati alla malattia.
"La gente pensa che la tau o l'amiloide-beta siano le cose che causano l'Alzheimer, ma la nostra scoperta suggerisce che dobbiamo pensare in modo più globale alle proteine che potrebbero impattare su tau o amiloide attraverso vie biochimiche", ha detto Saghatelian.
I risultati devono essere testati e confermati in studi su animali prima che i ricercatori possano essere sicuri che l'HtrA1 è il legame tra ApoE4 e Alzheimer negli esseri umani. Ma se saranno confermati, potrebbero farci capire meglio la malattia e indicare nuove potenziali strategie di trattamento.
Fonte: Salk Institute (> English text) - Traduzione di Franco Pellizzari.
Riferimenti: Qian Chu, Jolene K. Diedrich, Joan M. Vaughan, Cynthia J. Donaldson, Michael F. Nunn, Kuo-Fen Lee, Alan Saghatelian. HtrA1 Proteolysis of ApoE In Vitro Is Allele Selective. Journal of the American Chemical Society, 2016; 138 (30): 9473 DOI: 10.1021/jacs.6b03463
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.



 Associazione Alzheimer OdV
Associazione Alzheimer OdV