Identificato un 'precursore' cruciale nella formazione patologica delle fibrille proteiche
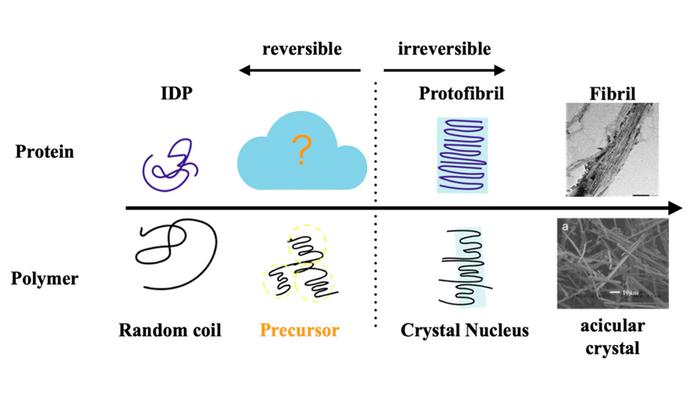 La fibrillazione della proteina tau rispecchia la cristallizzazione dei polimeri. (Fonte: Università Metropolitana di Tokio)
La fibrillazione della proteina tau rispecchia la cristallizzazione dei polimeri. (Fonte: Università Metropolitana di Tokio)
Ricercatori della Tokyo Metropolitan University hanno applicato idee della fisica dei polimeri per fare luce sul meccanismo alla base di una patologia chiave nel morbo di Alzheimer (MA), la formazione di fibrille di proteine tau. Hanno dimostrato che la formazione delle fibrille è preceduta dalla nascita di grandi gruppi (cluster) di proteine, che rispecchiano la cristallizzazione dei polimeri. La dissoluzione di questi gruppi ha contribuito in modo cruciale a prevenire la formazione di fibrille nella soluzione. Il loro lavoro segna un cambiamento di paradigma per lo sviluppo di trattamenti per le malattie neurodegenerative.
Il MA continua a costituire un'immensa sfida per gli scienziati, sia per comprenderne la progressione che per sviluppare trattamenti efficaci. Con l’invecchiamento della popolazione in tutto il mondo, la posta in gioco non potrebbe essere più alta. La maggior parte degli approcci sono passati attraverso le lenti della farmacologia e della scienza medica; data l’enorme complessità della malattia, le discipline adiacenti sono diventate sempre più importanti nel presentare nuove direzioni e intuizioni di ricerca.
Ora, un team guidato dal professor Rei Kurita della Tokyo Metropolitan University ha usato approcci basati sulla fisica dei polimeri per comprendere una delle patologie chiave del MA, la formazione di fibrille della proteina tau. Sono stati ispirati dal processo gerarchico mediante il quale i polimeri, molecole a catena lunga, formano cristalli ben ordinati. Invece di singoli filamenti che si uniscono sui cristalli in modo graduale, molti polimeri creano strutture intermedie, “precursori”, prima dei ri-arrangiamenti necessari per formare i cristalli.
Applicando queste idee alla proteina tau umana in soluzione, hanno potuto confermare che la nascita delle fibrille (fibrillazione) è preceduta dalla formazione di una struttura precursore simile, un ammasso sciolto di proteina tau con dimensioni di decine di nanometri. Hanno verificato queste strutture con tecniche indipendenti, come la diffusione dei raggi X a piccolo angolo e metodi basati su fluorescenza. Fondamentalmente, hanno dimostrato che questi precursori non erano solidi, ma strutture sciolte e transitorie che potevano essere dissolte modificando la quantità di cloruro di sodio in presenza di eparina, un anticoagulante naturale nel corpo umano.
Le soluzioni in cui queste strutture a grappolo erano dissolte o soppresse non mostravano quasi alcuna formazione di fibrille. Il team ha proposto un meccanismo attraverso il quale si riduceva l'interazione tra eparina e proteina tau nella soluzione, rendendo più difficile la formazione di gruppi; la maggiore concentrazione di ioni carichi ha portato le molecole cariche, come tau ed eparina, a nascondersi più efficacemente l’una dall’altra attraverso un processo noto come 'screening' elettrostatico.
I risultati del team suggeriscono un paradigma completamente nuovo per lo sviluppo di trattamenti, in cui si potrebbe puntare alla formazione reversibile dei precursori invece di tentare di smontare le fibre finali. Si tratta di un passo avanti cruciale non solo per la comprensione e il trattamento del MA, ma per una gamma più ampia di malattie neurodegenerative, compreso il Parkinson.
Fonte: Tokyo Metropolitan University via EurekAlert! (> English) - Traduzione di Franco Pellizzari.
Riferimenti: T Takahashi, [+5], R Kurita. Hindering tau fibrillization by disrupting transient precursor clusters. Neurosci Res, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV