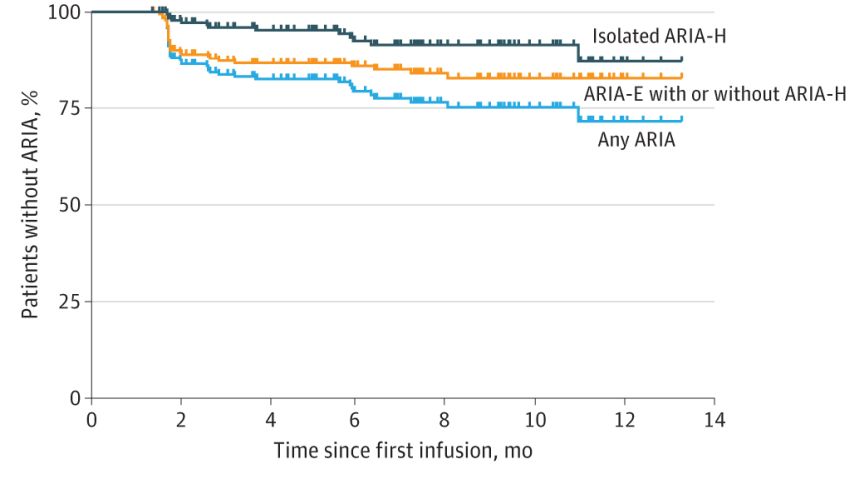
 Pazienti senza ARIA (in %) nei primi 14 mesi di infusioni di lecanemab. Fonte: Paczynski et al / WashU / Jama Network
Pazienti senza ARIA (in %) nei primi 14 mesi di infusioni di lecanemab. Fonte: Paczynski et al / WashU / Jama Network
L'approvazione nel 2023 della FDA del lecanemab - una nuova terapia per il morbo di Alzheimer (MA) che negli studi clinici ha dimostrato solo un modesto rallentamento della progressione della malattia, commercializzato con il nome di Leqembi - è stata accolta con entusiasmo da molti del settore in quanto rappresentava il primo farmaco del suo tipo in grado di influenzare la malattia. Ma durante gli studi clinici sono emersi effetti collaterali - gonfiore e sanguinamento del cervello - che hanno lasciato pazienti e medici titubanti sul trattamento.
I farmaci possono avere effetti in qualche modo diversi una volta rilasciati nel mondo reale con dati demografici più ampi. I ricercatori della Washington University di St. Louis (Missouri / USA) hanno deciso di studiare gli eventi avversi associati al trattamento con lecanemab nei loro pazienti clinici e hanno scoperto che eventi avversi significativi erano rari e gestibili.
Coerentemente con i risultati di studi clinici attentamente controllati, i ricercatori hanno scoperto che solo l'1% dei pazienti ha avuto gravi effetti collaterali che hanno richiesto il ricovero in ospedale. I ricercatori hanno scoperto che i pazienti nella prima fase del MA, con sintomi molto lievi, hanno avuto il rischio più basso di complicanze, aiutando a informare pazienti e medici quando discutono i rischi del trattamento.
Lo studio retrospettivo, pubblicato su Jama Neurology, si è concentrato su 234 pazienti con MA molto lieve o lieve che hanno ricevuto infusioni di lecanemab nel Memory Diagnostic Center della WashU Medicine, una clinica specializzata nel trattamento dei pazienti con demenza.
"Questa nuova classe di farmaci per il MA sintomatico precoce è l'unico trattamento approvato che influenza la progressione della malattia", ha affermato Barbara Joy Snider MD/PhD, prof.ssa di neurologia e coautrice senior dello studio. "Ma la paura che circonda i potenziali effetti collaterali del farmaco può portare a ritardi nel trattamento. Il nostro studio mostra che la clinica ambulatoriale della WashU ha l'infrastruttura e le competenze per somministrare in sicurezza e di assistere i pazienti sul lecanemab, compresi i pochi che possono sperimentare effetti collaterali gravi, aprendo la strada alla somministrazione sicura del farmaco da altre cliniche".
Il lecanemab è una terapia anticorpale che elimina le proteine della placca amiloide, estendendo la vita indipendente di 10 mesi, secondo un recente studio condotto dai ricercatori della WashU. Poiché l'accumulo di amiloide è il primo passo nella malattia, i medici raccomandano il farmaco per le persone nella fase iniziale del MA, con sintomi molto lievi o lievi. I ricercatori hanno scoperto che solo l'1,8% dei pazienti con sintomi di MA molto lieve ha sviluppato sintomi avversi dal trattamento rispetto al 27% dei pazienti con MA lieve.
"I pazienti con sintomi molto lievi di MA avranno probabilmente il maggiore beneficio e il minor rischio di eventi avversi dal trattamento", ha affermato la Snider, che ha condotto studi clinici sul lecanemab alla Washu Medicine. "Esitare ed evitare può portare i pazienti a ritardare il trattamento, che a sua volta aumenta il rischio di effetti collaterali. Speriamo che i risultati aiutino a riformulare le conversazioni tra medici e pazienti sui rischi del farmaco".
L'esitazione intorno al lecanemab deriva da un effetto collaterale noto come 'anomalie di scansione correlate all'amiloide' (ARIA, amyloid-related imaging abnormalities). Le anomalie, che in genere colpiscono solo un'area molto piccola del cervello, appaiono sulle scansioni cerebrali e indicano gonfiore o sanguinamento. Negli studi clinici del lecanemab, il 12,6% dei partecipanti ha avuto ARIA e la maggior parte dei casi è stato asintomatico e risolto senza intervento. Una piccola percentuale - circa il 2,8% dei partecipanti trattati - ha sperimentato sintomi come mal di testa, confusione, nausea e vertigini. Decessi occasionali sono stati collegati a LecaneMab in circa lo 0,2% dei pazienti trattati.
Il Memory Diagnostic Center ha iniziato a trattare i pazienti con LecaneMab nel 2023 dopo che il farmaco ha ricevuto l'approvazione completa della FDA. I pazienti ricevono il farmaco tramite infusioni ogni due settimane nei centri di infusione. Come parte delle cure di ciascun paziente, i medici della WashU eseguono regolarmente scansioni sofisticate per monitorare il cervello, che possono rilevare sanguinamento e gonfiore con grande sensitività. Il lecanemab è sospeso nei pazienti con sintomi da ARIA o con ARIA significativa senza sintomi e i rari pazienti con ARIA grave vengono trattati con steroidi in ospedale.
Nel guardare indietro ai risultati dei loro pazienti, gli autori hanno riscontrato l'entità degli effetti collaterali allineati con quelli degli studi: la maggior parte dei casi di ARIA in clinica sono stati asintomatici e scoperti solo su scansioni cerebrali sensibili usate per monitorare i cambiamenti cerebrali. Negli 11 pazienti che hanno avuto sintomi ARIA, gli effetti sono stati in gran parte risolti in pochi mesi e nessun paziente è morto.
"La maggior parte dei pazienti sul lecanemab tollera bene il farmaco", ha affermato Suzanne Schindler MD/PhD, prof.ssa associata di neurologia e coautrice senior dello studio. "Questo rapporto può aiutare i pazienti e i fornitori a comprendere meglio i rischi del trattamento, che sono più bassi nei pazienti con sintomi molto lievi di MA".
Fonte: Marta Wegorzewska in WashU Medicine (> English) - Traduzione di Franco Pellizzari.
Riferimenti: M Paczynski, [+19], BJ Snider. Lecanemab Treatment in a Specialty Memory Clinic. JAMA Neurology, 2025, DOI
Copyright: Tutti i diritti di testi o marchi inclusi nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non rappresenta necessariamente l'opinione dell'Associazione Alzheimer OdV di Riese Pio X ma solo quella dell'autore citato come "Fonte". I siti terzi raggiungibili da eventuali collegamenti contenuti nell'articolo e/o dagli annunci pubblicitari sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.






 Associazione Alzheimer OdV
Associazione Alzheimer OdV