Non ci sono ancora trattamenti efficaci per prevenire, fermare, o invertire l'Alzheimer, ma i progressi della ricerca negli ultimi tre decenni potrebbero cambiare questo quadro a tinte fosche.
Gli studi genetici dimostrano che la malattia ha molteplici cause. Approcci interdisciplinari che combinano la biologia biochimica molecolare e cellulare, e la modellazione transgenica hanno rivelato alcuni dei suoi meccanismi molecolari.
I progressi nella chimica, radiologia, e biologia dei sistemi stanno cominciando a fornire i biomarcatori utili, e l'emergere della medicina personalizzata è pronta a trasformare lo sviluppo farmaceutico e le sperimentazioni cliniche. Tuttavia, gli sforzi investigativi e di sviluppo dei farmaci dovrebbero essere diversificati per affrontare pienamente la multifattorialità della malattia.
Introduzione
L'Alzheimer (AD) è caratterizzata da progressiva perdita di memoria e di altre funzioni cognitive. Generalmente passa più o meno un decennio prima che la malattia prenda il suo corso e i pazienti muoiono in uno stato di completa impotenza. La lunga durata dell'AD e il suo attacco contro le fragili strutture che ospitano l'essenza stessa di ciò che siamo, costituisce un onere emotivo e finanziario enorme sui pazienti, le loro famiglie e la società. Si stima che il costo dell'AD nel mondo sia stato di 604 miliardi dollari nel solo 2010 (190). Questi costi sono impressionanti, soprattutto alla luce delle previsioni che il numero mondiale di casi di AD, attualmente stimato in 36 milioni, triplicherà entro il 2050 (190). Pochi sistemi sanitari saranno in grado di far fronte a questo sviluppo. Questo esame evidenzia alcuni degli sviluppi più informativi nel campo della ricerca di AD e solleva importanti questioni irrisolte.
Substrati del declino cognitivo
L'AD provoca una grande perdita di peso e volume del cervello e colpisce alcune regioni del cervello e delle popolazioni neuronali più delle altre (76). Anche se l'AD provoca chiaramente la perdita di neuroni in specifiche regioni cerebrali (ad esempio, di cellule piramidali a lamina II della corteccia entorinale e nella regione dell'ippocampo CA1), gran parte della perdita complessiva del volume del cervello sembra essere dovuta alla contrazione e perdita di processi neuronali. I progressi nella tecniche radiologiche di imaging ha fatto avanzare le misurazioni morfometriche dai tessuti post-mortem ai pazienti in vita (82). Ad esempio, può essere rilevata una diminuzione progressiva dello spessore corticale in varie regioni del cervello con la risonanza magnetica (MRI) nei pazienti con AD, in correlazione con il declino cognitivo, e prevedere la conversione da deterioramento cognitivo lieve (MCI) ad AD (66) (142). Di conseguenza, questa misura è sempre più utilizzata nella diagnosi precoce di Alzheimer e come biomarcatore negli studi clinici.
Al di là di tali alterazioni anatomiche, la risonanza magnetica funzionale (fMRI) ha rivelato alterazioni nelle attività di reti neurali nei pazienti con AD e nelle persone a rischio di sviluppare la malattia. Queste comprendono attività anomale e connettività nella cosiddetta rete in modo predefinito, che nelle persone sane è più attiva quando non si pensa a niente in particolare, e l'iperattivazione dell'ippocampo durante l'esecuzione di compiti di memoria (176), correlata alla diminuzione del volume ippocampale e all'anomalo calo di spessore corticale in regioni del cervello vulnerabili all'AD (142). Coerentemente con i dati elettrofisiologici e biochimici ottenuti da relativi modelli di topi transgenici (135) (183), queste osservazioni suggeriscono che l'AD non si limita a silenziare i neuroni e le reti neurali, ma piuttosto fa un'aberrante attività di rete che potrebbe interferire attivamente con i processi complicati alla base dell'apprendimento, della memoria e delle altre funzioni cognitive. Inoltre, l'iperstimolazione di specifiche popolazioni neuronali potrebbe causare eccitotossicità, che probabilmente contribuisce alla neurodegenerazione in AD e nelle condizioni correlate. E' interessante a questo proposito che l'AD è associato ad una maggioe incidenza di crisi epilettiche, che è più evidente nei pazienti con forme della malattia ad esordio precoce (134). I risultati in modelli di topi transgenici suggeriscono che queste complicanze possono essere la punta di un iceberg, rappresentando una escalation di alterazioni più impercettibili di attività della rete neurale (135) (183).
Molte prove suggeriscono che le sinapsi e i dendriti, le specializzazioni attraverso le quali i neuroni rispettivamente inviano e ricevono segnali, sono particolarmente vulnerabili all'AD. La perdita di sinapsi e spine dendritiche si correla meglio al declino cognitivo in AD della perdita di neuroni (137). La rarefazione sinaptodendritica si osserva anche in colture neuronali e nel cervello di topi transgenici esposti a fattori sospettati di causare AD. In questi modelli, la degenerazione è preceduta da alterazioni della funzione sinaptica e da attività di rete aberrante (121) (135), suggerendo che questi tipi di disfunzioni sono manifestazioni iniziali della malattia e, forse contribuiscono anche alla sua progressione.
I recenti progressi nella visualizzazione radiologica, hanno inoltre consentito l'individuazione di segni patologici dell'Alzheimer nei pazienti vivi, migliorando la precisione diagnostica e la selezione dei pazienti per gli studi clinici. Dopo essere stato iniettato nel flusso sanguigno, il composto Pittsburg-B (PIB) attraversa la barriera emato-encefalica (BBB) e si lega ai depositi fibrillari di peptidi beta-amiloide (Aβ) (placche amiloidi), il cui anomalo accumulo nel cervello è un requisito per la diagnosi patologica di AD. Il legame del PIB alle placche amiloidi può essere rilevato mediante tomografia a emissione di positroni (PET). Una moltitudine di altre sonde radiofarmaceutiche sono state sviluppate per la rilevazione delle placche e grovigli neurofibrillari (NFT) (107), altro segno distintivo della patologica di AD.
Mentre la rilevazione di questi segni patologici nei pazienti vivi ha chiaramente valore diagnostico, è ancora incerto se queste caratteristiche contribuiscono davvero alla disfunzione cognitiva in AD e se essi rappresentano misure di esito utili per gli studi clinici. I carichi di placche, determinate istopatologicamente o radiologicamente, non si correlano bene con le menomazioni funzionali, come illustrato più sorprendente da parte di persone con notevoli oneri di placche e cognizione normale (71). Recenti studi hanno dimostrato un'associazione tra l'aumento del vincolo del PIB e lo sviluppo di AD 5 anni più tardi (131), interpretato come una probabile relazione causa-effetto. Tuttavia, alcuni casi con AD autosomico dominante mostrano alti livelli di vincolo PIB nei gangli basali, ma non la maggiore propensione a sviluppare deficit motorio extrapiramidale, indicando disfunzione di queste regioni del cervello, rispetto ai casi con Alzheimer sporadico, che hanno diverse distribuzioni di legatura PIB (185).
Inoltre, ereditare la mutazione E693Δ in Aβ, che inibisce la formazione di fibrille amiloidi insolubili e promuove la formazione di oligomeri Aβ solubili, provoca una sindrome che ricorda clinicamente molto l'AD, ma non sembra essere associato ad un significativo aumento in legatura PIB cerebrale (170). E poi il modello di accumulazione di PIB differisce tra i pazienti con AD sporadica ad esordio tardivo e quelli affetti da duplicazione del locus APP (150). Queste osservazioni e una grande massa di dati ottenuti nei modelli di topi transgenici (137) (135), consiglia cautela nell'interpretazione che le placche sono la causa principale e che la distrofia neuritica associata alle placche è il substrato principale del declino cognitivo in AD.
Anche se i NFT si correlano più strettamente con il declino cognitivo in AD rispetto alle placche (71), i risultati ottenuti nei modelli di topi transgenici indicano che i NFT non alterano necessariamente la funzione neuronale e che la proteina associata ai microtubuli tau, il componente principale dei grovigli neurofibrillari, può causare disfunzione neuronale indipendentemente da queste strutture, come nella recensione di 132.
Presi insieme, questi studi suggeriscono che una aberrante attività di rete neurale, la disfunzione e perdita di sinapsi, e la degenerazione di specifiche popolazioni neuronali sono i substrati principali del declino cognitivo in AD. Come descritto di seguito, è probabile che queste alterazioni siano causate da interazioni copatogeniche tra vari fattori e percorsi.
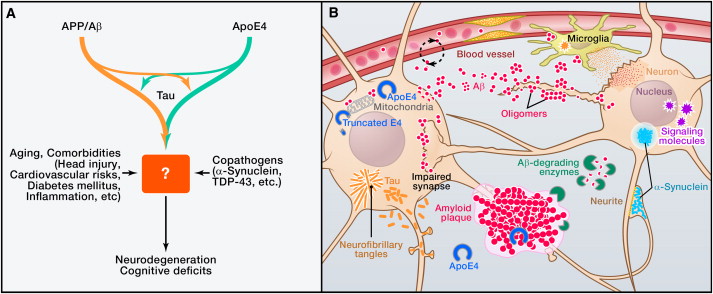 Figura 1: Base multifattoriale della patogenesi di Alzheimer (A) L'Alzheimer (AD) è probabilmente causata da interazioni copatogeniche tra molteplici fattori, tra cui APP/Aβ, apoE4, tau, α-sinucleina, TDP-43, l'invecchiamento, e varie comorbidità. Rimane da determinare come esattamente queste concorrano a compromettere le funzioni neuronali e la sopravvivenza. (B) L'aggregazione e l'accumulo di Aβ nel cervello può risultare da un aumento della produzione di Aβ, diminuita degradazione degli enzimi di degradazione dell'Aβ o da ridotta eliminazione attraverso la barriera emato- encefalica. Gli oligomeri Aβ compromettono le funzioni sinaptiche e le relative vie di segnalazione, cambiando l'attività neuronale, e innescando il rilascio di mediatori neurotossici dalle cellule gliali. Placche amiloidi fibrillari spostano e distorcono i processi neuronali. La proteina di trasporto dei lipidi apoE4 altera l'eliminazione dell'Aβ e ne promuove il deposito. Quando espresso all'interno dei neuroni stressati, l'apoE4 è scisso (in misura molto maggiore rispetto all'apoE3) in frammenti neurotossici che inficiano il citoscheletro e compromettono le funzioni mitocondriali. La Tau, che normalmente è più abbondante negli assoni, si localizza erroneamente rispetto al soma neuronale e ai dendriti e forme di inclusioni chiamate grovigli neurofibrillari (NFT). L'α-sinucleina può anche auto-assemblarsi in oligomeri patogeni e formare aggregati più grandi (corpi di Lewy). Sia la tau che l'α-sinucleina possono anche essere rilasciate nello spazio extracellulare, dove possono diffondersi ad altre cellule. Le anomalie vascolari mettono in pericolo la fornitura di sostanze nutritive e la rimozione dei sottoprodotti metabolici, causano microinfarti, e promuovono l'attivazione delle cellule gliali.
Figura 1: Base multifattoriale della patogenesi di Alzheimer (A) L'Alzheimer (AD) è probabilmente causata da interazioni copatogeniche tra molteplici fattori, tra cui APP/Aβ, apoE4, tau, α-sinucleina, TDP-43, l'invecchiamento, e varie comorbidità. Rimane da determinare come esattamente queste concorrano a compromettere le funzioni neuronali e la sopravvivenza. (B) L'aggregazione e l'accumulo di Aβ nel cervello può risultare da un aumento della produzione di Aβ, diminuita degradazione degli enzimi di degradazione dell'Aβ o da ridotta eliminazione attraverso la barriera emato- encefalica. Gli oligomeri Aβ compromettono le funzioni sinaptiche e le relative vie di segnalazione, cambiando l'attività neuronale, e innescando il rilascio di mediatori neurotossici dalle cellule gliali. Placche amiloidi fibrillari spostano e distorcono i processi neuronali. La proteina di trasporto dei lipidi apoE4 altera l'eliminazione dell'Aβ e ne promuove il deposito. Quando espresso all'interno dei neuroni stressati, l'apoE4 è scisso (in misura molto maggiore rispetto all'apoE3) in frammenti neurotossici che inficiano il citoscheletro e compromettono le funzioni mitocondriali. La Tau, che normalmente è più abbondante negli assoni, si localizza erroneamente rispetto al soma neuronale e ai dendriti e forme di inclusioni chiamate grovigli neurofibrillari (NFT). L'α-sinucleina può anche auto-assemblarsi in oligomeri patogeni e formare aggregati più grandi (corpi di Lewy). Sia la tau che l'α-sinucleina possono anche essere rilasciate nello spazio extracellulare, dove possono diffondersi ad altre cellule. Le anomalie vascolari mettono in pericolo la fornitura di sostanze nutritive e la rimozione dei sottoprodotti metabolici, causano microinfarti, e promuovono l'attivazione delle cellule gliali.
Eziologia 'MultiFazione' dell'AD
Genetica, epigenetica ed epidemiologia
L'AD è probabilmente causato da complesse interazioni tra molteplici fattori genetici, epigenetici e ambientali. Le mutazioni in tre geni (proteina precursore amiloide (APP), presenilina (PS) - 1 e PS-2) causano l'insorgenza precoce (<60 anni) di AD autosomica dominante (13), che rappresenta probabilmente meno dell'1% dei casi di AD (31). Le mutazioni che influenzano l'elaborazione dell'APP, portano alla produzione alterata di diversi peptidi Aβ e, quindi, ai relativi rapporti (13). I pazienti con sindrome di Down portatori di una copia extra del cromosoma 21, dove risiede il gene APP, sviluppano demenza precoce con segni patologici dell'Alzheimer nel cervello (127), in coerenza con l'idea che la sovraespressione dell'APP causa AD ad esordio precoce. A forte sostegno di questa nozione, la duplicazione del gene APP da sola porta all'AD ad esordio precoce (155). Inoltre, un aumento dell'espressione del gene APP causato da variazioni genetiche nella sequenza promotrice può essere un fattore di rischio per l'AD ad insorgenza tardiva, dove i livelli di espressione dell'APP si correlano inversamente all'età di esordio della malattia (23).
L'Apolipoproteina (apo) E4 (qui usato per riferirsi sia all'allele APOEε4 che alla proteina che esso codifica) è stato geneticamente legata all'AD ad esordio tardivo (>60 anni), familiare e sporadico, che rappresenta la maggior parte dei casi di AD, e ha un effetto in dose di gene (gene-dose) nell'aumentare il rischio e abbassare l'età di insorgenza della malattia (47, 63). Tutti gli studi di associazione dell'intero genoma ben condotti (GWASs) sull'AD ad esordio tardivo in diverse popolazioni di tutto il mondo hanno identificato l'apoE4 come il principale gene dell'AD ad insorgenza tardiva con confidenza estremamente elevata (13).
Sorprendentemente, la stima del rischio di sviluppare AD nell'arco della vita per gli individui con due copie dell'allele apoE4 (~2% della popolazione) è circa 60% all'età di 85 anni, e per quelli con una sola copia dell'allele apoE4 (~25% della popolazione) è circa del 30%. In confronto, il rischio di AD nell'arco di vita per quelli con due copie dell'allele apoE3 è ~10% all'età di 85 anni. Quindi l'apoE4 deve essere considerato un gene importante, con ereditarietà semi-dominante, per l'AD ad esordio tardivo (69). Anche un recente GWAS ha identificato l'apoE4 come l'unico gene significativo associato al declino cognitivo correlato all'età, negli esseri umani (52), in linea con uno studio longitudinale che mostra che declino della memoria correlato all'età dei portatori di apoE4 senza demenza diverge da quello dei portatori con demenza prima dei 60 anni (32). Quindi l'effetto negativo dell'apoE4 sulla cognizione si verifica prima che sorgano i segni tipici dell'Alzheimer. Al contrario, l'apoE2 può proteggere contro l'AD in alcune popolazioni (63).
I GWAS hanno inoltre individuato altri geni che modulano il rischio di AD ad esordio tardivo, tra cui CLU, CR1, PICALM, BIN1, SORL1, GAB2, ABCA7, MS4A4/MS4A6E, CD2AP, CD33, EPHA1, e HLA-DRB1/5 (13) (118). Comunque il contributo relativo di questi geni all'AD è modesto rispetto all'apoE4.
Meccanismi epigenetici possono avere un ruolo nella patogenesi dell'Alzheimer (51). Studi postmortem su campioni di cervello umano e su leucociti periferici, così come su modelli animali transgenici, hanno dimostrato che l'invecchiamento e l'AD sono associati alla disregolazione epigenetica a vari livelli, compresa la metilazione anormale del DNA e le modifiche degli istoni (41). Anche se non è chiaro se i cambiamenti epigenetici osservati in AD rappresentino una causa o una conseguenza della malattia, studi sui gemelli supportano l'idea che meccanismi epigenetici modulano il rischio di AD (41). È interessante notare che, l'inibizione farmacologica della metilazione del DNA nell'ippocampo dopo un compito di apprendimento, ha disturbato il consolidamento della memoria nei topi (51), e la promozione dell'acetilazione degli istoni ha migliorato apprendimento e memoria in un modello murino di Alzheimer e ha aumentato l'espressione genica legata all'apprendimento nei topi anziani selvatici (65) (138), suggerendo una regolazione epigenetica dell'apprendimento e della memoria in salute e malattia.
L'invecchiamento è il più importante fattore noto di rischio non genetico per l'AD ad insorgenza tardiva. I potenziali fattori di rischio ambientali per l'AD tardivo comprendono trauma cranico, bassi livelli di istruzione, iperlipidemia, ipertensione, omocisteinemia, diabete mellito e obesità (8) (154) (167) (181). Tuttavia, molte di queste associazioni restano controverse (50). Le combinazioni dell'apoE4 con uno o più di questi fattori di rischio ambientali possono aumentare ulteriormente i rischi per AD ad esordio tardivo e declino cognitivo legato all'età (33) (81).
L'Aβ e altri prodotti APP
I peptidi Aβ, il principale costituente delle placche amiloidi, e vari altri metaboliti, derivano dall'APP per scissione proteolitica (43) (53). Varie linee di evidenze supportano l'ipotesi che APP e Aβ contribuiscono causalmente alla patogenesi dell'AD (Figura 2). La sovraespressione dell'APP negli esseri umani attraverso la duplicazione del suo gene, o trisomia del cromosoma 21, causa AD ad insorgenza precoce (vedi sopra), al contrario della parziale trisomia 21, escludendo il gene APP (141). La sottounità catalitica del complesso proteico γ-secretasi, che rilascia peptidi Aβ dal suo precursore, è formata da PS1 e PS2. Le mutazioni autosomiche dominanti in APP, PS1, PS2 che alterano l'elaborazione dell'APP e la produzione o auto-aggregazione di Aβ, promuovendo l'aggregazione e l'accumulo di Aβ nel cervello, causano AD ad insorgenza precoce (13). L'espressione neuronale dell'APP umana mutante (hAPP) da sola o in combinazione con il PS1 mutante nei roditori transgenici cause diverse alterazioni di tipo AD, come recensito in precedenza (2) (103) (121) (135) (144) e descritta sotto.
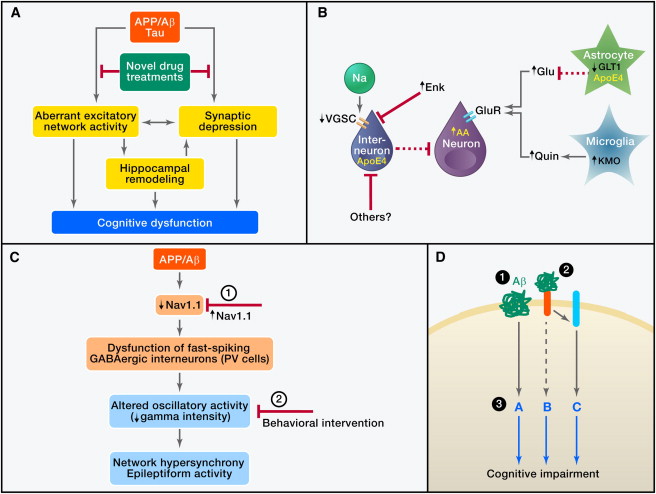 Figura 2: L'Aβ nella patogenesi di AD e relative strategie terapeutiche (A) L'insieme di Aβ patogeni causa attività aberrante eccitatoria di rete dipendente dalla tau e la depressione sinaptica, che può portare direttamente, o indirettamente via rimodellamento dell'ippocampo, alla disfunzione cognitiva. Identificazione e blocco dei meccanismi a monte che attivano questa catena di eventi sono obiettivi importanti. (B) L'attività di rete aberrante Aβ-dipendente può essere causata da disturbi ai interneuroni inibitori derivanti dal depauperamento delle subunità di canali di sodio controllati dal voltaggio (VGSC), dall'attività intracellulare di frammenti neurotossici di apoE4, o da elevati livelli di metenkephalin (Enk). Altri meccanismi che possono causare una sovraeccitazione dei neuroni in AD comprendono la compromissione dei trasportatori del glutammato (es.: GLT1), con conseguente diminuzione dell'eliminazione di glutammato (Glu) e l'incremento della produzione neuronale o microgliale di fattori che promuovono la eccitotossicità, tipo l'acido arachidonico (AA) e l'acido chinolinico (Quin). (C) Topi hAPP hanno svuotamenti delle subunità Nav1.1 delle VGSC che compromettono la funzione degli interneuroni inibitori (cellule PV) positivi alla parvalbumina (PV), con conseguente ridotta intensità delle oscillazioni gamma e ipersincronia di rete. Queste anomalie di rete possono essere impedite aumentando i livelli di Nav1.1 nelle cellule PV (1) e contrastate, almeno temporaneamente, da interventi comportamentali che migliorano l'attività gamma (2). (D) L'Aβ può compromettere le funzioni neuronali attraverso meccanismi mediati o indipendenti dal recettore. Le strategie terapeutiche potenziali comprendono (1) abbassare la produzione di Aβ con inibitori o modulatori secretasi e migliorare l'eliminazione dell'Aβ con anticorpi o attivando enzimi di degradazione dell'Aβ, (2) bloc- care l'interazione dell'Aβ con i recettori di superficie cellulare, e (3) modulare i percorsi a valle per rendere il cervello più resistente contro qualsiasi Aβ che non può essere rimossa in modo efficace e sicuro.
Figura 2: L'Aβ nella patogenesi di AD e relative strategie terapeutiche (A) L'insieme di Aβ patogeni causa attività aberrante eccitatoria di rete dipendente dalla tau e la depressione sinaptica, che può portare direttamente, o indirettamente via rimodellamento dell'ippocampo, alla disfunzione cognitiva. Identificazione e blocco dei meccanismi a monte che attivano questa catena di eventi sono obiettivi importanti. (B) L'attività di rete aberrante Aβ-dipendente può essere causata da disturbi ai interneuroni inibitori derivanti dal depauperamento delle subunità di canali di sodio controllati dal voltaggio (VGSC), dall'attività intracellulare di frammenti neurotossici di apoE4, o da elevati livelli di metenkephalin (Enk). Altri meccanismi che possono causare una sovraeccitazione dei neuroni in AD comprendono la compromissione dei trasportatori del glutammato (es.: GLT1), con conseguente diminuzione dell'eliminazione di glutammato (Glu) e l'incremento della produzione neuronale o microgliale di fattori che promuovono la eccitotossicità, tipo l'acido arachidonico (AA) e l'acido chinolinico (Quin). (C) Topi hAPP hanno svuotamenti delle subunità Nav1.1 delle VGSC che compromettono la funzione degli interneuroni inibitori (cellule PV) positivi alla parvalbumina (PV), con conseguente ridotta intensità delle oscillazioni gamma e ipersincronia di rete. Queste anomalie di rete possono essere impedite aumentando i livelli di Nav1.1 nelle cellule PV (1) e contrastate, almeno temporaneamente, da interventi comportamentali che migliorano l'attività gamma (2). (D) L'Aβ può compromettere le funzioni neuronali attraverso meccanismi mediati o indipendenti dal recettore. Le strategie terapeutiche potenziali comprendono (1) abbassare la produzione di Aβ con inibitori o modulatori secretasi e migliorare l'eliminazione dell'Aβ con anticorpi o attivando enzimi di degradazione dell'Aβ, (2) bloc- care l'interazione dell'Aβ con i recettori di superficie cellulare, e (3) modulare i percorsi a valle per rendere il cervello più resistente contro qualsiasi Aβ che non può essere rimossa in modo efficace e sicuro.
Diverse linee di evidenza suggeriscono che l'Aβ regola le attività neuronali e sinaptiche e che l'accumulo di Aβ nel cervello provoca una intrigante combinazione di attività di rete aberrante e depressione sinaptica (Figura 2A) (135). Il deterioramento degli interneuroni inibitori e la stimolazione aberrante dei recettori del glutammato, che può causare eccitotossicità, sembrano svolgere ruoli importanti a monte di questa cascata patogenica (Figura 2B e 2C) (126) (135) (161) (183). L'attività neuronale aberrante potrebbe innescare un circolo vizioso aumentando la produzione di Aβ, che è regolata, almeno in parte, dall'attività neuronale (12). Il gene precoce immediato Arc, che si lega direttamente al PS1 per regolare il traffico dell'γ-secretasi, è necessario per la produzione di Aβ dipendente dall'attività neuronale (192).
I risultati ottenuti in diversi modelli sperimentali suggeriscono che le fibrille di Aβ insolubili presenti nelle placche amiloidi e l'Aβ monomerica sono meno patogeni degli insiemi non-fibrillari solubili di Aβ, come i dimeri Aβ, i trimeri e gli oligomeri più grandi (Figura 1B). Tuttavia, gli assemblaggi di Aβ sono in gran parte patogeni e il modo in cui il loro accumulo nel cervello causa la disfunzione sinaptica e neuronale sono temi irrisolti di intenso studio e di dibattito (10) (117) (135). Queste frazioni possono agire extracellularmente e intracellularmente e coinvolgere le proteine come pure i lipidi.
Diverse molecole della superficie cellulare sono state implicate in tossicità dell'Aβ indotta da oligomero (Figura 2D), incluso il recettore chinasi tirosina EphB2 (42) e il recettore per i prodotti finali della glicazione avanzata (178). I potenziali meccanismi a valle includono i cambiamenti nella distribuzione o nell'attività dei recettori neurotrasmettitori e delle relative molecole di segnalazione (101) (117) (135) (151) (153), rottura dell'omeostasi del calcio intracellulare (30) e deterioramento nel trasporto assonale e delle funzioni mitocondriali (55) (58) (144) (169) (186).
Un ostacolo attuale importante nel campo è la mancanza di tecniche per quantificare in maniera affidabile l'abbondanza di insiemi solubili di Aβ nel tessuto cerebrale, in particolare sulle membrane neuronali. Questo problema ha precluso la correlazione tra disturbi cognitivi nei pazienti di AD con i livelli di questi insiemi in luoghi strategici. Ha inoltre reso impossibile sapere se uno qualsiasi dei farmaci relativi all'Aβ sottoposti a sperimentazioni cliniche ha effettivamente ridotto i livelli di insiemi funzionalmente rilevanti di Aβ in regioni del cervello AD-vulnerabili. Altre incertezze circa il valore di farmaci che abbassano l'Aβ riguardano le potenziali funzioni fisiologiche dell'APP e i diversi metaboliti APP, tra cui l'Aβ (59) (74) (115) (143) (189) (195) e la domanda se l'APP stesso o i metaboliti APP diversi dall'Aβ (es.: i frammenti C-terminali C99, il dominio intracellulare o il C31) contribuiscono alla patogenesi di AD (70) (86) (174).
L'ApoE4
L'impatto principale dell'apoE4 sul rischio di AD contrasta chiaramente con la relativamente piccola quantità di attenzione che ha ricevuto sul campo, rispetto, ad esempio, all'APP, all'Aβ, alla tau, e all'infiammazione. Per favorire il miglioramento di questa situazione, rivedremo la patobiologia dell'apoE4 in modo più approfondito qui. Poichè l'apoE4 è stato identificato come un fattore di rischio genetico per l'AD, studi in-vitro e in-vivo hanno esplorato le sue proprietà strutturali e le funzioni in neurobiologia, le sue attività cellulari fisiologiche e fisiopatologiche dipendenti dalla fonte nel cervello, e i suoi ruoli dipendenti e indipendenti dall'Aβ nella patogenesi dell'AD (Figura 3).
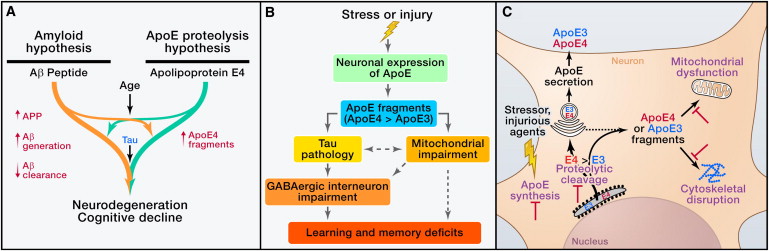 Figura 3: L'ApoE4 nella patogenesi di AD e relative strategie terapeutiche. (A) L'ApoE4 ha probabilmente sia un ruolo dipendente che uno indipendente dall'Aβ nella patogenesi di AD. L'ApoE4 compromette l'eliminazione dell'Aβ e promuove la deposizione di Aβ (a sinistra). Inoltre, l'apoE4 neuronale subisce una scissione proteolitica per generare frammenti neurotossici, contribuendo alla patogenesi di AD indipendentemente dall'Aβ (a destra). (B) L'ipotesi proteolisi apoE suggerisce che, in risposta a stress o lesioni, viene attivata l'espressione neuronale di apoE per facilitare la riparazione neuronale. Tuttavia, l'apoE neuronale subisce una scissione proteolitica, perchè l'apoE4 è più sensibile alla scissione dell'apoE3, causando la formazione di frammenti neurotossici. I frammenti apoE4 entrano nel citosolo e causano la patologia tau e il danno mitocondriale. Gli interneuroni GABAergici ilari nel giro dentato sono particolarmente vulnerabili alla tossicità dei frammenti di apoE4 e il deterioramento risultante contribuisce ai deficit di apprendimento e memoria. (C) L'espressione neuronale dell'apoE e neurotossicità dell'apoE correlata alla proteolisi rappresentano obiettivi per lo sviluppo di terapie innovative. L'inibizione dell'espressione dell'apoE4 nei neuroni dovrebbe ridurre il livello di sostanze tossiche dei frammenti di apoE4 e dei loro effetti negativi a valle. L'identificazione della proteasi che fende l'apoE in neuroni dovrebbe consentire lo sviluppo di specifici inibitori della proteasi per ridurre la produzione di frammenti apoE neurotossici. Può anche essere possibile sviluppare farmaci per proteggere i mitocondri e il citoscheletro dall'attacco dei frammenti tossici di apoE.
Figura 3: L'ApoE4 nella patogenesi di AD e relative strategie terapeutiche. (A) L'ApoE4 ha probabilmente sia un ruolo dipendente che uno indipendente dall'Aβ nella patogenesi di AD. L'ApoE4 compromette l'eliminazione dell'Aβ e promuove la deposizione di Aβ (a sinistra). Inoltre, l'apoE4 neuronale subisce una scissione proteolitica per generare frammenti neurotossici, contribuendo alla patogenesi di AD indipendentemente dall'Aβ (a destra). (B) L'ipotesi proteolisi apoE suggerisce che, in risposta a stress o lesioni, viene attivata l'espressione neuronale di apoE per facilitare la riparazione neuronale. Tuttavia, l'apoE neuronale subisce una scissione proteolitica, perchè l'apoE4 è più sensibile alla scissione dell'apoE3, causando la formazione di frammenti neurotossici. I frammenti apoE4 entrano nel citosolo e causano la patologia tau e il danno mitocondriale. Gli interneuroni GABAergici ilari nel giro dentato sono particolarmente vulnerabili alla tossicità dei frammenti di apoE4 e il deterioramento risultante contribuisce ai deficit di apprendimento e memoria. (C) L'espressione neuronale dell'apoE e neurotossicità dell'apoE correlata alla proteolisi rappresentano obiettivi per lo sviluppo di terapie innovative. L'inibizione dell'espressione dell'apoE4 nei neuroni dovrebbe ridurre il livello di sostanze tossiche dei frammenti di apoE4 e dei loro effetti negativi a valle. L'identificazione della proteasi che fende l'apoE in neuroni dovrebbe consentire lo sviluppo di specifici inibitori della proteasi per ridurre la produzione di frammenti apoE neurotossici. Può anche essere possibile sviluppare farmaci per proteggere i mitocondri e il citoscheletro dall'attacco dei frammenti tossici di apoE.
Polimorfismsi e Funzioni dell'ApoE in Neurobiologia. L'ApoE è una proteina polimorfica con 3 isoforme comuni negli umani: apoE2, apoE3 e apoE4. Le 3 isoforme differiscono l'una dall'altra dalla sostituzione di singoli aminoacidi (120). L'ApoE ha ruoli importanti e vari in neurobiologia (26) (94) (106) (120). Ha ruoli specifici per ogni isoforma nella rimodellazione dei neuriti: l'apoE3 stimola la sovracrescita dei neuriti, e l'apoE4 la inibisce (94) (95) (120). L'ApoE inotre raccoglie i lipidi generati dalla degenerazione neuronale e li ridistribuisce alle cellule che richiedono lipidi per la proliferazione, riparazione della membrana, o per la rimielinizzazione di nuovi assoni (94) (120). Si sono osservate alterazioni sinaptiche e dendritiche nei topi carenti di apoE (122) e nei topi transgenici che esprimono l'apoE4 nei neuroni (27). Inoltre l'apoE modula la funzione del recettore del glutammato e la plasticità sinaptica, regolando il riciclo del recettore apoE nei neuroni, dove l'apoE3 stimola e l'apoE4 inibisce il processo (36).
L'interazione tra i domini N- e C-terminale è una proprietà biofisica unica dell'apoE4 (202). Studi sia cristallografici che biofisici hanno rivelato che questa interazione tra domini è mediata da una formazione salata a ponte tra Arg-61 e Glu-255 (202). La mutazione di Arg-61 in treonina o del Glu-255 in alanina nell'apoE4 impedisce l'interazione tra domini e fa diventare l'apoE4 simile all'apoE3 (202). L'interazione tra domini è responsabile del traffico intraneuronale deteriorato dell'apoE4 (22), della suscettibilità dell'apoE4 alla proteolisi (95) (120), del deterioramento indotto dall'apoE4 nella sovracrescita dei neuriti, e nel funzionamento mitocondriale (22) (37), e nella disfunzione astrocitica associata all'apoE4 (202).
Ruoli dipendenti dalla fonte cellulare dell'apoE4 nella patogenesi di AD. ApoE derivati da diverse fonti cellulari hanno ruoli distinti nei persorsi sia fisiologici che patofisioligicai (94) (95) (120). Gli astrociti sono riconosciuti da tempo come fonte primaria di apoE nel cervello, e l'espressione dell'apoE negli astrociti aumenta nell'invecchiamento e in risposta agli estrogeni e all'attivazione del recettore X del fegato o NF-κB (94) (95) (120). Studi in-vitro e in-vivo suggeriscono che l'apoE derivato dagli astrociti ha effetti diversi per ogni isoforma sull'eliminazione dell'Aβ o nel suo deposito (106), nella crescita dei neuriti (90), e nella prestazione comportamentale (87).
Anche i neuroni del sistema nervoso centrale esprimono l'apoE, ma in gran parte in risposta a stress e lesioni (94) (193). E' interessante notare che gli elementi condizionati dagli astrociyi sovraregolano l'espressione dell'apoE nei neuroni, e questa regolazione è controllata dalla ritenzione/giunzione introne-3 del gene apoE attraverso il percorso extracellulare del kinase regolato dalla segnalazione (85) (194). Gli apoE3 e apoE4 derivati dai neuroni differiscono nel traffico intracellulare (22), nella suscettibilità alla proteolisi (20), e negli effetti sulla funzione mitocondriale (35) (37), nella fosforilazione della tau (20), lisosomale (100) e integrità neuronale (27), nei livelli del recettore androgeno (147), e nelle funzioni cognitive (145). E' interessante notare che, quando espresso nei neuroni, l'apoE3 è eccito-protettivo, mentre l'apoE4 non lo è; comunque, quando espressi negli astrociti, l'apoE3 e l'apoE4 sono ugualmente eccito-protettivi (29). Quindi la fonte cellulare dell'apoE influenza marcatamente le attività fisiologiche e patopfisiologiche. Un meccanismo potenzialmente sottostante questi effetti differenziati è la proteolisi dell'apoE4, che genera frammenti neurotossici e avviene nei neuroni ma non negli astrociti (95).
Ruoli dell'apoE4 dipendenti dall'Aβ nella patogenesi di AD. In-vivo, l'apoE è associato alle placche di amiloide e in-vitro apoE3 e apoE4 senza lipidi possono formare complessi stabili con peptidi Aβ, e l'apoE4 può formare complessi con più rapidità ed efficacia (94) (106). Gli studi nei topi con deficenza di apoE, che esprimono hAPP mutante, dimostrano che attualmente è richiesto apoE per la formazione di placche amiloidi fibrillari (4) (92). Comunque, quando incubati con peptidi Aβ, gli apoE3 e apoE4 lipidati fanno scaturire risultati diversi. L'ApoE3 lega l'Aβ con una affinità 20 volte maggiore dell'apoE4, suggerendo che l'apoE lipidato differisce dall'apoE senza lipidi nell'abilità di interagire con i peptidi Aβ (94) (106). Interessante è anche che diminuendo lo stato di lipidazione dell'apoE, buttando fuori l'ABCA1 nei topi che esprimono hAPP mutante, aumenta significativamente il carico di amiloide cerebrale, mentre aumentando lo stato di lipidazione dell'apoE sovraesprimendo l'ABCA1 diminuisce i livelli di amiloide (106). Quindi alterare la lipidazione dell'apoE modifica la sua abilità di mediare l'eliminazione dell'Aβ o il suo deposito nel cervello.
Nei topi transgenici hAPP, l'apoE umano stimola l'eliminazione di Aβ. ApoE2 e apoE3 eliminano più Aβ dell'apoE4 (4) (92), che potrebbe essere collegato agli effetti dell'apoE dipendenti dalle isoforme sulla degradazione astrogliale dei depositi di Aβ (110). Misurando il tasso di eliminazione dell'Aβ mediante microdialisi nei cervelli di topi transgenici hAPP che esprimono apoE3 o apoE4, si è scoperto che l'apoE4 riduce l'eliminazione di Aβ di circa il 40% in confronto all'apoE3 (34). Uno recente studio ha dimostrato che l'apoE4 troncato dal C-terminal, che si trova nel cervello di AD, elimina in modo non efficiente l'Aβ e agisce in concerto con l'Aβ per suscitare deficit neuronali e comportamentali nei topi transgenici (15). Studi in-vitro e in-vivo suggeriscono che il recettore lipoproteina a bassa densità (LDL), la relativa proteina-1 (LRP1), e il recettore lipoproteina a bassissima densità (VLDL) sono tutti coinvolti nell'eliminazione dell'Aβ mediata dall'apoE dal cervello (26) (54) (106).
Pur essendo noto che l'apoE4 aumenta l'accumulo di Aβ e la formazione di placche di amiloide sia negli umani che nei modelli di topo transgenico (Figure 3 A), non è ancora chiaro se questo processo contribuisce relamente ai deficit cognitivi di AD. Come indicato sopra, il carico di placche determinato istopatologicamente o radiologicamente non si correla bene al deficit cognitivo negli umani (71). Inoltre nei più anziani (>90 anni), la presenza di apoE2 è associata a un minore rischio di demenza ma a un carico maggiore di amiloide, relativo all'apoE3 (11).
Ruoli dell'apoE4 -indipendenti dall'Aβ- nella patogenesi di AD. Sono state istituite diverse linee di topi transgenici o finalizzati a un gene, che esprimono l'apoE3 o l'apoE4 umano, senza la co-espressione di hAPP mutante. Topi transgenici che esprimono l'apoE4 nei neuroni su un sottofondo di topo senza Apoe mostrano deficits -in funzione dell'età e del genere femminile- nell'apprendimento spaziale e nella memoria, che non sono presenti nei topi con specifici neuroni apoE3 (145) (146). Studi morfologici hanno dimostrato che l'apoE3 neuronale, a differenza dell'apoE4, impedisce la neurodegenerazione dipendente dall'età vista nei topi senza apoE, come pure la neurodegenerazione indotta da eccitotossine (29) (27). L'ApoE4 fa degenerare anche la sinaptogenesi e riduce la densità delle spine dendritiche in-vivo nei topi transgenici apoE e finalizzati a un gene, e in-vitro nelle colture neuronali primarie (22) (60).
Inoltre le cellule staminali neurali nei topi adulti esprimono apoE e l'apoE4 compromette la neurogenesi ippocampale adulta (116), il che potrebbe anche contribuire ai deficits di apprendimento e memoria asociati all'apoE4. Poichè non c'è accumulazione di Aβ in nessuno di questi modelli di topo apoE4, questi dati suggeriscono fortemente un ruolo dell'apoE4 independente dall'Aβ nel causare deficits neuronali e comportamentali in-vivo. A sostegno di questo principio, sono stati rilevati effetti dell'apoE4 sullo spessore corticale, sull'attività cerebrale e sulle funzioni mitocondriali nei bambini o in studenti universitari (64) (168), cioè molto prima che avvenga una accumulazione significativa di Aβ nel cervello umano (19).
Si è ipotizzato che, in risposta a stress o lesioni cerebrali, sia indotta l'espressione di apoE neuronale con lo scopo di riparare o rimodellare. Importante è che questo processo causa anche eliminazione proteolitica di apoE4, provocando frammenti che portano a disfunzione e degenerazione neuronale (Figure 2B & 2C) (94) (95) (120). In effetti, l'apoE4 neuronale è più suscettibile dell'apoE3 neuronale all'eliminazione proteolitica, con il risultato di generare frammenti neurotossici troncati da C-terminale (Brecht et al., 2004). I frammenti di apoE sono presenti a livelli molto più alti nel cervello di pazienti di AD rispetto a quelli di controlli senza demenza, di pari età e sesso (84) (102). I topi transgenici che esprimono frammenti di apoE troncati da C-terminal hanno neurodegenerazione nell'ippocampo e mostrano deficits di apprendimento spaziale e di memoria (1) (84).
L'apoE4 troncato da C-terminale aumenta la fosforilazione della tau e la formazione di inclusioni intracellulari di tipo NFT nelle cellule neuronali in coltura e nei topi transgenici (Figures 3 B & 3C) (94) (95) (120). Quindi la neurotossicità indotta dai frammenti di apoE4 potrebbe essere collegata alla formazione di specie di tau neurotossiche. In linea con questa ipotesi, la rimozione di tau endogena impedisce deficits neuronali e comportamentali nei topi transgenici con frammenti di apoE4 (1). I frammenti di apoE4 puntano anche ai mitocondri neuronali, portando disfunzione e neurotossicità mitocondriale (35) (37). E' importante che la disfunzione mitocondriale nell'AD è maggiore nei portatori di apoE4 che in quelli con apoE3 (72). L'apoE4 è anche associato a minore metabolismo cerebrale del glucosio sia nei pazienti con AD che in quelli senza demenza (175), cosa che probabilmente riflette le disfunzioni mitocondriali dipendenti dall'apoE4.
Deterioramento degli i nterneuroni GABAergici indotto dall'ApoE4. I topi colpiti dall'apoE4 mostrano una riduzione, dipendente dall'età, negli interneuroni GABAergici ilarici, che si correla all'entità di degenerazione indotta dall'apoE4 nella neurogenesi ippocampale adulta e ai deficits di apprendimento e memoria (1) (116). Nei topi transgenici che esprimono frammenti neurotossici di apoE4, la perdita di interneuroni ilarici è più pronunciata e si correla anche ai deficits di apprendimento e memoria (1). Questi effetti negativi sono dalla rimozione della tau (1). I topi trattati con pentobarbital, potenziatore del recettore GABAA, mostrano normalità nella neurogenesi, apprendimento e memoria (1) (116). Questi risultati suggeriscono con forza che l'apoE4 causa degenerazione -dipendente da età e tau- agli interneuroni GABAergici ilarici, portando a ridotta neurogenesi nell'ippocampo e a deficit di apprendimento e memoria (Figure 3 B).
La disfunzione del sistema GABAergico può contribuire anche al deterioramento cognitivo negli umani. I pazienti di AD hanno ridotti livelli di GABA e somatostatine nel cervello e nel liquido cerebrospinale, e queste alterazioni sono più gravi nei portatori di apoE4 (79). L'apoE4 è associato a maggiore attività cerebrale a riposo e in risposta a compiti di memoria (56) (64), forse riflettendo un disturbo nel controllo di inibizione GABAergico. Un polimorfismo mono-nucleotide nel gene somatostatina aumenta il rischio di AD nei portatori di apoE4, ma non di apoE3 (182). Inoltre il livelli di GABA nel CSF umano si riducono con l'età (7), il maggiore fattore di rischio di AD. Noi ipotizziamo che l'apoE4 contribuisca alla patogenesi di AD, almeno in parte, causando deterioramento dipendente dall'età degli interneuroni GABAergici (Figura 3B).
La tau e altri co-patogeni
L'AD è chiaramente una multiproteinopatia dove varie proteine assumono potenzialmente conformazioni patogeniche e si accumulano, separatamente o insieme, nel cervello. In base alla definizione patologica della malattia, l'AD è associata non solo all'anomala accumulazione di placche amiloidi, ma anche con quella dei NFT (grovigli neurofibrillari). I NFT si formano intracellularmente e sono costituiti principalmente di tau aggregata con modificazioni anomale post-traduzionali, comprese maggiori fosforilazione e acetilazione (45) (96) (130). Diverse scoperte recenti hanno sfidato l'opinione tradizionale che la tau serva principalmente per stabilizzare i microtubuli e che la sua aggregazione in AD causi i deficits attraverso un meccanismo di perdita di funzionalità (132). Studi in colture di cellule e in modelli di topi geneticamente modificati suggeriscono che la tau potrebbe normalmente facilitare o rafforzare la neurotrasmissione eccitatoria regolando la distribuzione delle molecole relative all'attività di segnalazione sinaptica (132). Comunque quando è alterata anormalmente e assume conformazioni patogeniche, la tau si arricchisce di spine dendritiche, potendo interferire con la neurotrasmissione (93). Gli oligomeri Aβ promuovono questo arricchimento postsinaptico della tau attraverso un processo che coinvolge i membri della famiglia di kinasi che regolano le affinità dei microtubuli (MARK) (Yu et al., 2012; 200).
È interessante notare che la riduzione tau impedisce all'Aβ di causare deficits neuronali nelle cellule in coltura e nei topi transgenici hAPP (132). Quindi nonostante l'Aβ agisca a monte della tau, i suoi effetti negativi dipendono in buona parte dalla tau (Figura 4). Queste conclusioni sono coerenti con gli studi genetici: le mutazioni nell'APP o presenilina che causano l'accumulo di Aβ nel cervello causano l'AD con le placche amiloidi e i NFT (13), mentre le mutazioni della tau causano NFT, ma non causano nè placche amiloidi nè AD (Figura 4). Le ultime mutazioni causano invece degenerazione lobare frontotemporale (6). L'apoE4 e i suoi frammenti aumentano la fosforilazione e l'accumulazione della tau nel soma neuronale e nei dendriti (1) (20) (84). Inoltre la riduzione della tau impedisce anche i deficit neuronali originati dall'apoE4 in-vitro e in-vivo (1), individuando la tau come il mediatore o abilitatore chiave della patogenesi dipendente sia dall'Aβ che dall'apoE4 (Figura 4). Come visto sopra, le isoforme dell'apoE modulano sia la deposizione di Aβ che i deficit sinaptici e cognitivi indipendenti dalle placche nei topi hAPP, dove l'apoE4 ingrandisce e l'apoE3 contrasta le anormalità, evidenziando ulteriormente le relazioni co-patogeniche tra Aβ, tau e apoE4.
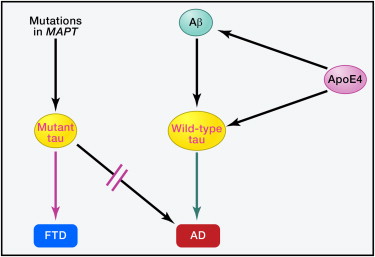 Figura 4: Ruoli della Tau nelle diverse Tauopatie Le mutazioni nel MAPT, il gene che codifica la tau, resultano nella produzione di tau mutante e causano certe forme di demenza frontotemporale (FTD), ma mai AD. Nell'AD, l'Aβ e l'apoE4 agiscono a valle della tau grezza ma i loro effetti dipendono, almeno in parte, dalla tau la cui struttura o funzione può essere alterata da anomala post-traduzione, modificazione, errata localizzazione o altre variabili. In effetti la riduzione della tau impedisce ai frammenti di Aβ e apoE4 di causare deficit neuronale e comprtamentale nei modelli di topo. Rimane da scoprire l'esatto meccanismo per cui la tau contribuisce alla disfunzione e degenerazione neuronale in AD, FTD e altre tauopatie.Una grande percentuale dei casi di AD ha anche accumuli anormali della proteina presinaptica α-sinucleina e della proteina TDP-43 che lega l'RNA nel cervello (89). Come per la tau, forme mutanti di queste proteine non causano l'AD, ma altre patologie neurodegenerative. L'Aβ migliora l'errata piegatura e l'accumulo di α-sinucleina in-vitro e in-vivo, e studi sui topi doppiamente transgenici suggeriscono che queste molecole possono sinergizzare fino a compromettere più gravemente le funzioni neuronali (123). Allo stesso modo frammenti di apoE4 possono aumentare l'accumulo di TDP-43 nei neuroni dei pazineti di FTD (187).
Figura 4: Ruoli della Tau nelle diverse Tauopatie Le mutazioni nel MAPT, il gene che codifica la tau, resultano nella produzione di tau mutante e causano certe forme di demenza frontotemporale (FTD), ma mai AD. Nell'AD, l'Aβ e l'apoE4 agiscono a valle della tau grezza ma i loro effetti dipendono, almeno in parte, dalla tau la cui struttura o funzione può essere alterata da anomala post-traduzione, modificazione, errata localizzazione o altre variabili. In effetti la riduzione della tau impedisce ai frammenti di Aβ e apoE4 di causare deficit neuronale e comprtamentale nei modelli di topo. Rimane da scoprire l'esatto meccanismo per cui la tau contribuisce alla disfunzione e degenerazione neuronale in AD, FTD e altre tauopatie.Una grande percentuale dei casi di AD ha anche accumuli anormali della proteina presinaptica α-sinucleina e della proteina TDP-43 che lega l'RNA nel cervello (89). Come per la tau, forme mutanti di queste proteine non causano l'AD, ma altre patologie neurodegenerative. L'Aβ migliora l'errata piegatura e l'accumulo di α-sinucleina in-vitro e in-vivo, e studi sui topi doppiamente transgenici suggeriscono che queste molecole possono sinergizzare fino a compromettere più gravemente le funzioni neuronali (123). Allo stesso modo frammenti di apoE4 possono aumentare l'accumulo di TDP-43 nei neuroni dei pazineti di FTD (187).
Meccanismi potenzialmente comuni
Come Aβ, tau e α-sinucleina possono esistere in stati diversi di assemblaggio, e diverse linee di evidenza suggeriscono che gli aggregati minori come gli oligomeri solubili sono più patogeni rispetto agli aggregati fibrillari grandi, insolubili, e altamente ordinati (132) (191). Una domanda interessante che rimane pendente è se la patogenicità in-vivo di queste e altre proteine associate a malattie neurodegenerative, dipende da conformazioni specifiche (es.: strutture a fogli piegati a β) e se le proteine richiedono l'auto-aggregazione o il legame ad altre proteine per assumere questi stati conformazionali. Almeno per la tau e l'α-sinucleina, entrambi i quali sono proteine intrinsecamente disordinate, è concepibile che anche i monomeri possano assumere conformazioni patogeniche in condizioni che promuovono l'errata piegatura della proteina. Si sono recentemente avute evidenze sperimentali di un tale scenario per la huntingtina che porta espansioni ripetute della poliglutamina associata alla malattia (129).
Resta ancora da determinare se le varie conformazioni patogene delle proteine o assiemi compromettano le funzioni neuronali attraverso meccanismi comuni, distinti, o in parte sovrapposti. Le interazioni co-patogeniche che sono state identificate tra tau, apoE4, Aβ, e α-sinucleina (vedi sopra) suggeriscono che ci sono dei meccanismi a valle su cui probabilmente convergono gli effetti di queste proteine.
Punti di convergenza possibili sono: anomalie nell'attività o nella distribuzione dei recettori neurotrasmettitori e delle cascate di segnalazione a valle, eccitotossicità, disregolazione della omeostasi del calcio intracellulare, alterazioni del trasporto intracellulare di carichi critici, menomazioni mitocondriali, disregolazione epigenetica, e l'impegno dei cicli patogeni gliali. E' un peccato che l'identificazione di tali diverse possibilità sia spesso erroneamente interpretata come polemica o mancanza di comprensione. Dopo tutto, anche le proteine normali spesso hanno molteplici funzioni e attività diverse in circostanze diverse; le citochine, come la TGF-β sono un buon esempio. Non c' è alcuna ragione per cui l'attività delle proteine patogene sia meno complessa. Di conseguenza, i diversi meccanismi citati sopra, chiaramente non si escludono a vicenda. In effetti, alcuni di essi possono essere correlati, ad esempio, a deficit di trasporto intracellulare e disfunzione mitocondriale.
Inoltre, l'anomala piegatura e l'accumulo di varie proteine, potrebbe genericamente stressare e, infine, sovraccaricare la macchina cellulare di gestione delle proteine. Molte prove suggeriscono che l'autofagia è il meccanismo principale attraverso il quale le cellule eliminano gli aggregati anomali di proteine (83). Nella forma più comune di AD autosomica dominante, il PS1 mutante può interrompere l'autofagia direttamente impedendo la proteolisi lisosomiale, mentre in altre forme di AD, il deterioramento dell'autofagia può coinvolgere diversi fattori genetici o ambientali (133). I tentativi di ripristinare la normale proteolisi lisosomiale e l'autofagia nei modelli murini di AD hanno prodotto effetti terapeutici promettenti, abbassando i livelli di Aβ e migliorando la funzionalità neuronale, come pure le prestazioni cognitive (133) (140) (196).
Un altro interessante aspetto di Aβ, tau, α-sinucleina ed altre proteine associate a patologie neurodegenerative è la loro capacità di perpetuare la patologia attraverso una diffusione da cellula a cellula e seminando aggregazioni proteiche anormale nei modelli sperimentali. Queste proprietà sono state paragonate a quelle dei prioni, forme diverse dei quali causano la malattia di Creutzfeldt-Jacob, la scrapie, e la malattia della mucca pazza (18) (104). Tuttavia, i prioni differiscono sostanzialmente dalle altre proteine, nel senso che causano le malattie che sono trasmissibili, mentre l'AD e la maggior parte delle altre malattie neurodegenerative non lo sono.
E' ben noto che i disturbi neurodegenerativi sono strettamente legati all'invecchiamento. Tuttavia, resta incerto se questo legame è specificamente causato da processi legati all'invecchiamento o riflette semplicemente il tempo necessario perchè i processi patogeni rilevanti si sviluppino. Mutazioni genetiche che accelerano l'accumulo di proteine patogene nel cervello possono chiaramente sostituire il "requisito" invecchiamento e causare AD o altre malattie neurodegenerative nelle persone di mezza età o anche giovani. Tuttavia, diverse linee di evidenza sperimentale vanno a sostegno dell'idea che l'AD e le altre condizioni neurodegenerative possono essere attivate da specifici fattori legati all'invecchiamento, come il progressivo venir meno dei meccanismi di neuroprotezione o di eliminazione delle proteine e la comparsa di comorbidità (88) (125) (184). L'infiammazione può essere una componente chiave di un invecchiamento non sano (163).
Ultimo, ma non meno importante, sia l'Aβ che l'apoE4 possono contribuire alla disfunzione della rete e della cognizione alterando specifiche popolazioni di interneuroni inibitori che normalmente regolano l'attività delle principali cellule eccitatorie (Figures 2B, 2C e 3B). Gli interneuroni GABAergici, a innesto rapido, positivi alla parvalbumina, nella corteccia parietale di topi hAPP hanno ridotto i livelli di subunità canale del sodio, chiusi via tensione (VGSC) (Figure 2B e 2C), e alterazioni simili sono presenti nei pazienti con AD (183). Aumentando il livello di queste subunità del canale del sodio nei topi transgenici, si migliorano le oscillazioni gamma, le attività di rete e le funzioni cognitive. L'attività esplorativa aumenta anche l'intensità gamma e riduce un'ipersincronia di rete in alcuni topi. L'ApoE4 e dei suoi frammenti causano menomazioni -dipendenti da età e tau- ai interneuroni GABAergici positivi alla somatostatina, negli ilo del giro dentato, con conseguente deficit di apprendimento e memoria (Figura 3B). La stimolazione della segnalazione GABA inverte questi deficit (1). Quindi, migliorare la funzione degli interneuroni può essere un'interessante nuovo spunto per interventi terapeutici in AD.
Test Preclinici e Clinici
Inibitori dell'Acetilcolina esterasi e Memantina
I farmaci che sono attualmente approvati dalla FDA per il trattamento di AD inibiscono l'acetilcolina esterasi per aumentare i livelli del neurotrasmettitore acetilcolina, che si esaurisce nel cervello di AD, o antagonizzare i recettori del glutammato di tipo NMDA, per evitare la stimolazione neuronale aberrante (48). L'impatto di questi farmaci sulle manifestazioni della malattia è modesto e transitorio, anche se studi osservazionali suggeriscono che il trattamento combinato può aumentare il tempo prima che i pazienti necessitano di istituzionalizzazione (119). Non ci sono prove convincenti, però, che questi agenti possano prevenire, bloccare o invertire la malattia.
Puntare all'Aβ
Sulla base dei scoperte rivoluzionarie effettuate durante gli ultimi due decenni, diverse terapie sono state sviluppate per ridurre la produzione o migliorare l'eliminazione dell'Aβ. Farmaci della prima categoria sono stati progettati per inibire β o γ-secretasi, gli enzimi che rilasciano Aβ dal suo precursore (43) (53) (75). Anche se l'identità di questi enzimi è nota da tempo, è stato difficile sviluppare farmaci che penetrano la BBB e inibiscono specificamente la scissione dell'APP senza influenzare il taglio di substrati alternativi come il Notch e le subunità di canali del sodio voltaggio-dipendenti (43) (53) (75). Uno studio clinico di fase III per un inibitore della γ-secretasi è stato recentemente arrestato a causa degli effetti collaterali compreso il peggioramento della disabilità cognitiva (166). Un'altra categoria di farmaci modula la scissione γ-secretasi dell'APP, diminuendo la produzione di Aβ42/43 in favore di specie più corte di Aβ che possono essere meno tossiche delle specie più lunghe (75) (105). Tuttavia, non è stato ancora rigorosamente escluso che le specie di Aβ più brevi contribuiscano anche alla disfunzione neuronale in-vivo, una possibilità che potrebbe limitare l'efficacia e la sicurezza dei modulatori γ-secretasi. Il modulatore γ-secretasi tarenflurbil era inefficace in uno studio di fase III (78). Sperimentazioni in corso valuteranno se inibitori γ-secretasi più selettivi, a risparmio di Notch o inibitori β-secretasi (BACE1) sono più efficaci e sicuri.
Gli sforzi per abbassare i livelli di Aβ mediante operazioni di maggiore eliminazione sono emersi dalla dimostrazione che l'immunizzazione attiva contro l'Aβ ha eliminato le placche amiloidi in topi transgenici hAPP (164). Un test di immunizzazione attiva negli esseri umani ha dovuto essere interrotto a causa degli effetti collaterali immunopatologici (73). E' stata tollerata meglio l'immunizzazione passiva via ripetute infusioni di anticorpi monoclonali umanizzati anti-Aβ in uno studio di fase II, anche se in una percentuale di pazienti sono state notate sulla MRI delle anomalie legate all'amiloide, compreso edema vasogenico e microemorragie (159) (177). Questo studio è stato successivamente esteso alla fase III con dosi minori dell'anticorpo nei vettori apoE4, che erano particolarmente suscettibili alle complicanze di cui sopra, e i risultati dovrebbero essere disponibili entro la fine dell'anno. Ulteriori sperimentazioni di terapie anti-Aβ comprendono farmaci che mirano a prevenire la formazione di grumi patogeni di Aβ, come lo scillo-inositolo, che ha mostrato zero efficacia in uno studio di fase II (160), e il PBT2, che si è mostrato preliminarmente promettente in un piccolo test di fase IIa (112).
Un approccio alternativo o complementare a quelli descritti sopra può essere quello di rendere il cervello più resistente a qualsiasi forma di Aβ che non può essere rimossa in modo efficace e sicuro (Figure 2A, 2C e 2D). Diverse strategie sperimentali sono state identificate che impediscono o invertono i disturbi neuronali e cognitivi dipendenti da hAPP/Aβ nei topi transgenici, comprese riduzioni di tau (132), fosfolipasi A2 del gruppo IV A (161), ciclofilina D (58), o Fyn (39); inversione di impoverimenti EphB2 o Nav1.1 (42) (183); e sostituzione di apoE4 con apoE3 (28) (146). Sono necessarie ulteriori ricerche per valutare ulteriormente il potenziale terapeutico e la sicurezza di queste strategie.
Puntare alla Tau
Sebbene molte meno sperimentazioni di farmaci si siano concentrati sulla tau, l'interesse per le terapie legate alla tau è in costante aumento negli ultimi anni, in parte a causa delle difficoltà incontrate con le strategie anti-Aβ (24) (75) (132). Nei pazienti umani con AD, le fenotiazine blu di metilene hanno mostrato un qualche segno promettente di poter rallentare la progressione della malattia in uno studio clinico di fase II condotto per un anno (80). Il blu di metilene è stato originariamente ritenuto capace di inibire le interazioni tau-tau, ma può anche ridurre la tau solubile attraverso altri meccanismi, poichè si sa cha ha molti obiettivi (165). Sono in programma studi di fase III con una formulazione più recente di blu di metilene (LMTX).
Poiché non è chiaro quale insieme o conformazione della tau sia responsabile della disfunzione e degenerazione neuronale dipendente dalla tau, è altrettanto incerto se l'abbondanza di questa struttura sia ridotta da uno dei bloccanti dell'aggregazione tau disponibili. In realtà, alcuni inibitori dell'aggregazione tau favoriscono la formazione di oligomeri tau potenzialmente tossici (179). Questo scenario ricorda lo stato attuale dei trattamenti anti-Aβ, dove è altrettanto poco chiaro se una qualsiasi delle strategie anti-Aβ che hanno subito o sono attualmente in uno studio clinico è in grado di ridurre significativamente l'abbondanza della maggior parte degli insiemi patogeni solubili di Aβ nei tessuti del cervello umano, qualsiasi cosa essi possano essere (10).
Poiché diverse linee di evidenza suggeriscono che la fosforilazione anomala contribuisce alla patogenicità della tau (93) (132) (200), continuano ad essere perseguiti come potenziali bersagli farmacologici per l'AD i chinasi tau, tra cui GSK-3β, CDK5, MARK e MAPK. Tuttavia, tutti questi chinasi hanno numerosi altri substrati oltre alla tau, sollevando preoccupazioni circa la sicurezza dei rispettivi inibitori, e finora nessun inibitore dei chinasi tau sembrano essere passati a una successiva fase di sperimentazione clinica per l'AD.
Una potenziale alternativa per modulare la fosforilazione della tau è la riduzione dei livelli complessivi di tau. Nei topi, il 50% di riduzione di tau endogena è ben tollerata, aumenta la resistenza alle crisi epilettiche indotte chimicamente, e riduce notevolmente i disturbi neuronali e cognitivi in-vivo indotti da frammenti di Aβ e apoE4 (132). Supponendo che gli esperimenti in corso confermino che la riduzione dei livelli complessivi di tau è efficace e sicura anche se iniziata in animali adulti ed anziani con patologie correlate all'AD, può essere utile ridurre i livelli di tau puntando la tau stessa o le molecole che regolano la sua espressione o eliminazione. Alcune molecole rilevanti sono già state identificate. Per esempio, il diidropiridine riduce i livelli di tau in colture cellulari (62).
Si ritiene che la tau sia degradata attraverso i percorsi ubiquitina-proteasoma e lisosomiale. La ligasi ubiquitina per la tau è stata identificata come il terminale C della proteina a interazione-HSP70 (CHIP). La riduzione dei livelli della CHIP ha aumentato l'accumulo di aggregati tau in topi transgenici con tau umana, e i livelli della CHIP sono ridotti nel cervello con AD (157). Inoltre, come suggerisce il nome, la CHIP opera in combinazione con le proteine a shock termico per regolare il degrado della tau (57); i livelli della proteina a shock termico 90 (Hsp90) si correlano inversamente ai livelli di tau solubile e degli oligomeri di tau (158).
Nel cervello di AD, la tau è iperacetilata, fatto che aumenta la sua emivita (130), altera il suo legame ai microtubuli, e migliora l'aggregazione (45). Poiché sia l'acetilazione che l'ubiquitinazione puntano ai residui di lisina, l'acetilazione della tau per mezzo dell'acetil transferasi p300 inibisce l'ubiquitinazione e stabilizza la tau (130). Inoltre, l'acetilazione dell'amminoacido 6 motivo VQIINK (PHF6*) inibisce la legatura della tau ai microtubuli e accresce l'aggregazione della tau (45). Questo motivo è cruciale per la formazione di oligomeri e filamenti tau (132). Quindi la combinazione tra l'inibizione dell'acetilazione della tau e il miglioramento della funzione del proteasoma potrebbe sinergizzarsi per abbassare il livello di specie patogene di tau.
Il degrado della tau può anche essere incrementato da meccanismi immuno-mediati. L'immunizzazione attiva che mirava la tau fosforilata ha ridotto le inclusioni filamentose di tau e la disfunzione neuronale nei topi transgenici di tau (3). Non è noto il meccanismo con cui vengono rimosse le proteine intracellulari, comprese tau ed α-sinucleina, tramite l'immunizzazione, ma può coivolgere la degradazione lisosomiale (124) (173). Una volta che gli anticorpi entrano nel cervello, potrebbero essere presi dalla endocitosi mediata da recettori e attivare l'autofagia (173) o interagire con tau o α-sinucleina nell'ambiente extracellulare.
E' stata osservata la distruzione dei microtubuli in diversi modelli di AD e FTLD, compresi topi transgenici tau e culture neuronali di tipo grezzo esposte a oligomeri Aβ (25) (132). In studi preclinici e clinici per l'AD hanno mostrato risultati promettenti gli stabilizzatori dei microtubuli. Ad esempio, il paclitaxel ha impedito la tossicità indotta da Aβ nelle cellule in coltura (200), così come il deficit di trasporto assonale e le menomazioni motorie nei topi transgenici tau (201). L'Epotilone D, che ha una migliore permeabilità alla BBB, migliora la densità e la cognizione dei microtubuli tau nei topi transgenici (25). Il peptide NAP stabilizza i microtubuli e riduce l'iperfosforilazione della tau (188), suggerendo che composti di stabilizzazione dei microtubuli possono avere più di un meccanismo d'azione. Il NAP può essere somministrato per via intranasale e ha mostrato qualche promessa in un test clinico di fase II (77).
Puntare all'ApoE4
Puntare agli Effetti dell'apoE4 dipendenti dall'Aβ. Gli approcci che puntano agli effetti dell'apoE4 dipendenti dall'Aβ si sono concentrati sulla modifica dei livelli di apoE o la sua proprietà di legare l'Aβ per aumentare l'eliminazione di Aβ o diminuine la deposizione (106). Gli studi negli esseri umani e sui topi transgenici mostrano che i livelli cerebrali di Aβ e la formazione di placche amiloidi dipendono dalle isoforme dell'apoE (apoE4> apoE3> apoE2) (34) (106). Anche i livelli cerebrali di apoE dipendono dall'isoforma, ma nella direzione opposta (apoE4 <apoE3 <apoE2) (5) (152). L'allele apoE4 è stato considerato ipomorfico perché i livelli di apoE4 nel plasma e nel cervello tendono ad essere inferiori a quelli dell'apoE3, caratteristica che potrebbe ridurre la capacità dell'apoE4 di eliminare l'Aβ. Sulla base di questa ipotesi, è stato proposto di aumentare l'espressione di apoE nel cervello sperando di stimolare l'eliminazione di Aβ e ridurne i livelli (5) (152). Tuttavia, studi recenti che hanno testato direttamente questa ipotesi nei topi hanno riferito che, aumentando i livelli dell'espressione di apoE3 o apoE4 in topi transgenici hAPP o hAPP/PS1 mutanti, in realtà ha avuto come conseguenza un aumento della deposizione di amiloide nel loro cervello (16) (108). Quindi, in contrasto con l'ipotesi originale, questi risultati suggeriscono che ridurree (invece di aumentare) l'espressione di apoE potrebbe essere un metodo promettente per ridurre i livelli cerebrali di Aβ e diminuire i carichi di placche. Sono necessari altri studi per verificare ulteriormente questa ipotesi alternativa.
Altri tentativi per attenuare la capacità dell'apoE4 di promuovere la deposizione di Aβ sono concentrati sul blocco dell'interazione tra apoE e Aβ (156) (197). Ad esempio, il peptide sintetico Aβ 12-28P, permeabile alla BBB, che è omologo al punto di legame dell'apoE in Aβ, ma contiene una sostituzione a singolo amminoacido strategica, e riduce la tossicità di Aβ in coltura cellulare e la deposizione di amiloide nei topi transgenici hAPP (156) (197). Tuttavia, questi risultati sono stati ottenuti in topi che esprimono apoE murino anziché umano. L'effetto dell'apoE murino sul metabolismo dell'Aβ si differenzia nettamente da quello ddell'apoE umano poichè l'apoE murino promuove la deposizione di Aβ, mentre l'apoE umano ne promuove l'eliminazione (15) (91). Pertanto, è ipotizzabile che, il blocco dell'interazione tra Aβ e l'apoE umano in giovane età, potrebbe promuovere la deposizione di sostanza amiloide.
Puntare agli effetti di apoE4 indipendenti dall'Aβ. Sono stati proposti diversi approcci per puntare agli effetti di apoE4 indipendenti dall'Aβ (Figura 3C). Un approccio è quello di identificare correttori con struttura a piccole molecole in grado di interrompere l'interazione del dominio apoE4 (94) (95) (120). Dal momento che l'interazione del dominio è responsabile di vari effetti negativi dell'apoE4 (22) (37) (94) (95) (120), bloccandolo si dovrebbe abolire o attenuare tali effetti negativi. Con questo obiettivo, sono state identificate piccole molecole con elevata potenza attraverso la modellazione farmacofora in silico assistita da struttura, progettazione razionale di farmaci e screening ad alta efficienza. Questi composti aboliscono l'interazione del dominio apoE4 in colture neuronali, migliorano traffico intracellulare dell'apoE4, e impediscono gli effetti negativi dell'apoE4 sulla crescita dei neuriti, la motilità e funzione mitocondriale, e la produzione di Aβ in colture di cellule neuronali (22) (37) (198). Un'altro approccio è quello di individuare la proteasi che parcellizza l'apoE4 e genera frammenti neurotossici, e sviluppare inibitori della proteasi specifici (94) (95) (120). In alternativa potrebbero essere utilizzati anticorpi monoclonali umanizzati specifici per i frammenti neurotossici di apoE per cancellare i frammenti stessi o bloccare le loro azioni nocive. Un ulteriore approccio è quello di proteggere i mitocondri e il citoscheletro dall'attacco dei frammenti tossici di apoE (94) (120). Anhce la riduzione dell'espressione di apoE4 nei neuroni dovrebbe ridurre il livello di frammenti tossici apoE e i loro effetti a valle (94). Infine, i peptidi sintetici mimetici apoE hanno dimostrato di essere neuroprotettivi in modelli murini di lesioni cerebrali acute e in un modello di Drosophila che sovraesprimeva hAPP (113) (162). Sebbene questi approcci che mirano agli effetti di apoE4 indipendenti dall'Aβ siano promettenti, sono tutti in una fase iniziale di sviluppo e devono essere valutati in modelli animali e, successivamente, in studi clinici per valutare ulteriormente il loro potenziale terapeutico.
Altri approcci teraputici
Poiché vi è abbondanza di prove di danno ossidativo, infiammazione e disturbi mitocondriali in AD (14) (67) (139), sono stati fatti diversi tentativi per rallentare la progressione della malattia con antiossidanti (114), farmaci anti-infiammatori (46), o presunti protettori mitocondriali (14). Tuttavia, sulla base della nostra interpretazione della letteratura, nessun trattamento efficace è emerso finora da questi sforzi. La terapia ormonale è stata deludente allo stesso modo (172). Un certo numero di interessanti strategie sperimentali sono attualmente allo studio che puntano alla disfunzione sinaptica o di rete (109) (135) (183), ai modulatori di invecchiamento (44) (68), o all'autofagia (83). Il tempo ci dirà se queste o altre nuove strategie possono diventare terapie più efficaci per l'AD.
Lezioni apprese e nuovi sviluppi
Nozioni di base
Per molti degli studi clinici che sono stati effettuati su pazienti con AD, non vi è alcuna chiara evidenza che il trattamento in realtà abbia avuto l'effetto desiderato sull'obiettivo previsto nelle regioni del cervello vulnerabili all'AD. Alcuni dei farmaci che erano stati testati in studi clinici avanzati potrebbero anche non riuscire a oltrepassare la BBB. Inoltre, l'entità della modulazione richiesta dall'obiettivo è spesso incerta, semplicemente perché la patobiologia relativa non è ancora stata elaborata in maniera sufficientemente dettagliata.
Ad esempio, quanto inibitore secretasi o anticorpo anti-Aβ ci vuole per abbassare funzionalmente i consistenti insiemi di Aβ dell'ippocampo e della corteccia entorinale ad un livello in cui essi non possono più mettere in pericolo le funzioni sinaptiche? E cosa succede ai substrati alternativi o ai epitopi a reazione incrociata potenziale a queste dosi? Le isoforme apoE incidono in modo differenziale sulle azioni o sull'efficacia dei farmaci testati? Che cosa dovrebbero esattamente realizzare i farmaci antinfiammatorinel cervello per contrastare l'AD e quale sarebbe una misura di buon esito per assicurare che questo obiettivo è stato raggiunto? Se arricchire la tau nelle spine dendritiche è cruciale per i suoi effetti patogeni, i farmaci associati alla tau modulano realmente la tau in questo compartimento subcellulare?
Ci sono una miriade di domande come queste che non hanno ancora avuto risposta e che probabilmente dovranno essere risolte per sviluppare e valutare rigorosamente le nuovo terapie di AD. Infatti, vi è un urgente bisogno che gli scienziati costruiscano una base di conoscenze più solida per l'AD e le altre patologie neurodegenerative per consentire una progettazione e una valutazione veramente razionale di nuove terapie.
Troppo poco, troppo tardi
E' possibile avere lezioni importanti da altre malattie croniche che si manifestano prevalentemente nelle persone anziane, in particolare le malattie cardiovascolari. Ad esempio, una gestione efficace dell'ipertensione spesso richiede la combinazione di farmaci che hanno differenti modalità di azione, quali diuretici, beta bloccanti e inibitori ACE. Potrebbe il deficit cognitivi di AD richiere una simile combinazione di diversi farmaci che, ad esempio, mirano l'Aβ, la tau, e l'apoE4? Se sono presenti diversi fattori di rischio in giovane età, la prevenzione di ictus, attacchi cardiaci, e cardiomiopatia ipertensiva richiede spesso di iniziare un approccio su più fronti molti anni, o decenni, prima che queste complicazioni normalmente si verifichino (smettere di fumare, perdere peso, abbassare la pressione sanguigna e il colesterolo, ecc). Tuttavia, una volta che queste complicanze si sono verificate, rispondono poco o niente a tali interventi.
I ricercatori di AD considerano sempre più il deteriormento cognitivo evidente al momento della comparsa clinica di AD come una complicazione dell'ultima fase di un processo che ha progredito in silenzio per molti anni (75). Essi hanno inoltre il sospetto che i fattori di rischio per l'AD potrebbero essere rilevabili decenni prima che siano identificati i primi disturbi sui test cognitivi. Questa linea di pensiero, e i nuovi dati che lo supportano, hanno recentemente portato ad una sostanziale revisione dei criteri diagnostici per la ricerca di AD (99). I nuovi criteri presuppongono che le manifestazioni cliniche di AD siano precedute da una lunga fase prodromica e pongono maggiore enfasi sui biomarcatori, quali la risonanza magnetica, le scansioni PIB, e misurazioni di Aβ e tau nel liquido cerebrospinale. Sono in corso sforzi promettenti per identificare i biomarcatori più sensibili e specifici che potrebbero consentire di individuare precocemente le persone a rischio di sviluppo della malattia e per valutare l'efficacia di nuovi trattamenti in studi clinici (82) (148). Tuttavia, a questo punto non abbiamo ancora gli equivalenti per l'AD della pressione arteriosa o delle misurazioni del colesterolo, che sono stati così utili nella prevenzione delle malattie cardiovascolari.
Per quanto ne sappiamo, tutte i test clinici precedenti e in corso per l'AD sono stati avviati in pazienti sintomatici, in cui la malattia potrebbe essere già progredita al punto in cui i trattamenti con potenziale preventivo sono diventati inefficaci. Le coorti di pazienti che vengono assemblate nella rete di AD a prevalenza ereditaria (DIAN) (9) e nell'Alzheimer's Prevention Initiative (API) (149) dovrebbero cambiare questa situazione, in quanto dovrebbero consentire la progettazione di test di prevenzione accuratamente tempificati nei portatori di mutazioni che prevedibilmente causano AD ad esordio precoce entro fasce di età relativamente ristrette.
La crescente enfasi sulla prevenzione solleva l'intrigante domanda se sia sicuramente possibile arrestare o invertire l'AD dopo che sono emerse le menomazioni cognitive. Mentre molti ricercatori di AD sono sempre più scettici su questa possibilità, gli autori hanno una prospettiva più ottimistica, soprattutto a causa della straordinaria plasticità del sistema nervoso, che supera di gran lunga quella di altri organi. Noi pensiamo che un cocktail di farmaci, che blocca non solo una, ma la maggior parte delle cause profonde della malattia, potrebbe avere effetti benefici anche nei pazienti di AD con deficit cognitivi, soprattutto se combinato con farmaci che ottimizzano l'attività di rete e promuovono la plasticità e la riparazione neurale. Il trattamento combinato ha certamente fatto un mondo di differenza nel trattamento di altre condizioni difficili come il cancro e l'AIDS. In particolare, queste storie biomediche di successo includono importanti miglioramenti nelle funzioni cognitive nelle persone con demenza associata ad HIV ben consolidata, a seguito della terapia antiretrovirale combinata (49).
La sicurezza prima di tutto?
Tuttavia, la maggior parte dei medici e dei parenti che si prendono cura di persone anziane hanno imparato dolorosamente che questa popolazione di pazienti fragili è soggetta a fallimenti terapeutici ed effetti collaterali. Le ragioni comprendono i cambiamenti nel metabolismo legati all'invecchiamento e la maturazione di comorbilità che richiedono più farmaci che possono interagire negativamente con i nuovi aggiunti al mix. Valutare la sicurezza e l'efficacia dei trattamenti combinati in questo contesto complesso è un compito scoraggiante. Il concetto degli interventi precoci di prevenzione (vedi sopra) alza ulteriormente la barra di sicurezza per i farmaci di AD, in quanto implica di trattare un gran numero di persone sane sotto altri aspetti, per periodi di tempo prolungati. Ma quanto può essere inaccettabile il rischio se l'alternativa è perdere la propria mente? Poiché la risposta a questa domanda varia ampiamente tra persone diverse, le agenzie di regolamentazione devono trovare il giusto equilibrio tra la tutela del pubblico dalla malattia e restringere indebitamente il progresso o la libertà di scelta. I progressi della biologia dei sistemi, l'emergere della medicina personalizzata, e l'uso di cellule differenziate da cellule staminali pluripotenti indotte, specifiche per paziente (iPSCs), per test preclinici su farmaci (17) (21) (97) faciliterà con molta probabilità questo compito impegnativo in futuro, in quanto questi sviluppi promettenti potrebbero migliorare la nostra capacità di preselezionare i soggetti per gli studi clinici che hanno la più alta probabilità di beneficiare da trattamenti specifici e una minima possibilità di subire effetti negativi.
L'eterogeneità delle popolazioni di pazienti e geni modificatori
Come descritto in precedenza, l'AD è una malattia neurodegenerativa complessa probabilmente causata da interazioni tra i molteplici fattori e percorsi genetici, epigenetici e ambientali. Questa multifattorialità contribuisce alla eterogeneità delle popolazioni di pazienti e rende difficile testare farmaci negli studi clinici senza pre-selezionare i gruppi di pazienti appropriati, abbinandoli ai farmaci più adatti (Figura 5). Per esempio, l'AD autosomica dominante ad esordio precoce e l'AD sporadica ad insorgenza tardiva sono la stessa malattia? L'AD che si presenta con deficit amnesici ha eziologia uguale o distinta da quella con deficit esecutivi? Mancano attualmente risposte definitive a queste domande, che però potrebbero avere un impatto importante sulla efficacia dei farmaci relativi all'Aβ, all'apoE4, o ad altri agenti patogeni. L'impatto dell'apoE4 sul rischio di AD è influenzato anche dall'etnia (63), introducendo un ulteriore livello di complessità. Pertanto, al di là dell'individuazione di biomarcatori precoci affidabili per l'AD nel complesso (vedi sopra), c'è la necessità di definire biomarcatori precoci per i sottotipi potenziali di AD.
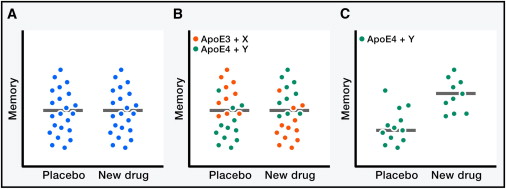 Figura 5: Impatto della eterogeneità dei pazienti e dei geni modificatori sulla speri- mentazione dei farmaci. Nuvole ipotetiche di dati i cui puntini rappresentano le misurazioni di memoria ottenute nei singoli soggetti umani. (A) Senza una migliore preselezione dei pazienti, i nuovi farmaci potenzialmente efficaci possono mostrare zero efficacia negli studi clinici a causa della eterogeneità della popolazione di pazienti testati. (B e C) La stratificazione della popolazioni di pazienti sulla base di misurazioni di biomarcatori e l'identificazione di specifici geni potrebbe aiutare a incrociare le sottopopolazioni con il farmaco più adatto e aumentare sensibilmente le possibilità di identificare migliori trattamenti per i disturbi di AD e relativi.Un'altro importante obiettivo è quello di determinare perché alcuni individui sono in grado di "scansare" l'impatto funzionale della malattia, anche quando hanno forti fattori di rischio, tipo l'apoE4 o una patologia AD ampia. Tra i fattori primi ad emergere in questa ricerca c'è la reelina, una glicoproteina della matrice extracellulare. Promuove la plasticità sinaptica, è impoverita nelle popolazioni di neuroni vulnerabili nei pazienti con AD e nei topi hAPP, e può contrastare la disfunzione sinaptica indotta da Aβ (40) (61). Un GWAS recente ha identificato le varianti del gene RELN che codifica la reelina, che sono associate con la normale funzione cognitiva nei pazienti anziani con notevole patologia di tipo AD (111). Studi in corso che utilizzano il sequenziamento dell'intero genoma e altri approcci di biologia dei sistemi, probabilmente riveleranno ulteriori fattori che impediscono l'insorgenza dell'AD in alcune persone contro ogni previsione e che, se efficacemente controllate, possono essere in grado di impedire quelle condizioni anche in altri.
Figura 5: Impatto della eterogeneità dei pazienti e dei geni modificatori sulla speri- mentazione dei farmaci. Nuvole ipotetiche di dati i cui puntini rappresentano le misurazioni di memoria ottenute nei singoli soggetti umani. (A) Senza una migliore preselezione dei pazienti, i nuovi farmaci potenzialmente efficaci possono mostrare zero efficacia negli studi clinici a causa della eterogeneità della popolazione di pazienti testati. (B e C) La stratificazione della popolazioni di pazienti sulla base di misurazioni di biomarcatori e l'identificazione di specifici geni potrebbe aiutare a incrociare le sottopopolazioni con il farmaco più adatto e aumentare sensibilmente le possibilità di identificare migliori trattamenti per i disturbi di AD e relativi.Un'altro importante obiettivo è quello di determinare perché alcuni individui sono in grado di "scansare" l'impatto funzionale della malattia, anche quando hanno forti fattori di rischio, tipo l'apoE4 o una patologia AD ampia. Tra i fattori primi ad emergere in questa ricerca c'è la reelina, una glicoproteina della matrice extracellulare. Promuove la plasticità sinaptica, è impoverita nelle popolazioni di neuroni vulnerabili nei pazienti con AD e nei topi hAPP, e può contrastare la disfunzione sinaptica indotta da Aβ (40) (61). Un GWAS recente ha identificato le varianti del gene RELN che codifica la reelina, che sono associate con la normale funzione cognitiva nei pazienti anziani con notevole patologia di tipo AD (111). Studi in corso che utilizzano il sequenziamento dell'intero genoma e altri approcci di biologia dei sistemi, probabilmente riveleranno ulteriori fattori che impediscono l'insorgenza dell'AD in alcune persone contro ogni previsione e che, se efficacemente controllate, possono essere in grado di impedire quelle condizioni anche in altri.
Valori e limiti dei modelli sperimentali
Le pressioni evolutive non consentono di prenderla molto comoda e hanno preservato molti processi e meccanismi attraverso specie diverse. Tuttavia, ci sono anche alcune differenze notevoli tra le specie che devono essere nate nella mente quando si cerca di estrapolarle da una all'altra (128). Ci sono buoni modelli sperimentali per l'AD? La risposta a questa domanda dipende interamente da ciò che ci si aspetta dai modelli. Se si cercano modelli che simulano tutti gli aspetti della condizione umana e permettono previsioni attendibili sull'efficacia dei farmaci e la sicurezza negli studi clinici, molto probabilmente si arriverà alla conclusione che non esistono modelli di buon AD. Al contrario, se si cercano modelli che possono aiutare a sviscerare la complessità della condizione umana e fornire informazioni utili sull'effetto patogenico ed sui meccanismi alla base di fattori specifici, ce ne sono molti.
Anche se molti tipi diversi di modelli possono dare informazioni, compreso il più riduzionista, è fondamentale confermare i risultati nei vari modelli e, infine, nella condizione umana. E' altrettanto importante regolare rapidamente le ipotesi di lavoro basate sulle nuove informazioni acquisite in questo processo. Ad esempio, l'Aβ favorisce l'aggregazione dell'α-sinucleina non solo in condizioni prive di cellule, ma anche in colture di cellule neuronali e in modelli di topi transgenici (123). Al contrario, anche se la tau stabilizza efficacemente i microtubuli in condizioni prive di cellule, non sembra essere necessario, per questo scopo, nelle cellule in coltura o nel cervello di topo adulto, mettendo in discussione il dogma che la funzione principale della tau è di stabilizzare i microtubuli (132).
I progressi nelle tecnologie iPSC e gli approcci connessi, permettono ora la generazione di cellule cerebrali umane dai fibroblasti derivati dal paziente o da cellule del sangue e hanno già permesso l'identificazione di fenotipi con potenziale rilevanza per la schizofrenia (21) e AD (97). Questi sviluppi emozionanti hanno rinnovato l'interesse nei modelli di coltura cellulare. Anche i tradizionali modelli di coltura cellulare si sono dimostrati molto utili nella ricerca sull'AD. Per esempio, ci hanno insegnato molto sull'elaborazione dell'APP, la produzione di Aβ, e gli effetti differenziali delle isoforme apoE, e molti dei risultati ottenuti in questi modelli hanno tenuto bene in modelli animali e umani (13) (43) (53) (75) (94) (95) (106) (120) (132) (135). Tuttavia, alcuni avvertimenti meritano di essere detti. Mentre le culture disperse sono adatte allo studio dei processi autonomi dalle cellule, esse disturbano le intricate relazioni che esistono tra i diversi tipi di cellule nel cervello e può alterare drasticamente l'attività di neuroni e glia e le rispettive risposte ai patogeni. Inoltre, resta da stabilire il modo migliore per simulare l'invecchiamento cerebrale in questi modelli, che ha un impatto così importante sullo sviluppo dell'AD e delle altre patologie neurodegenerative.
Questi aspetti della condizione umana sono più facilmente simulabili nei modelli animali. Topi o ratti geneticamente modificati per esprimere versioni umane di APP/Aβ, tau, isoforme di apoE, α-sinucleina, o altri fattori legati all'AD nelle cellule cerebrali, singolarmente o in combinazione, hanno dato una massa particolarmente alta di informazioni. Alcune delle intuizioni fornite da questi modelli sono state evidenziate nel testo sopra e molti sono stati esaminati in precedenza (2) (94) (95) (98) (103) (106) (120) (121) (132) (135) (144). Le selezioni che seguono evidenziano solo alcuni esempi.
L'espressione neuronale dell'hAPP che porta mutazioni che causano AD autosomica dominante, provoca una serie di anomalie di tipo AD nei topi transgenici, inclusi i livelli patologicamente elevati di Aβ nel cervello, deficit di apprendimento e memoria, alterazioni comportamentali, deficit sinaptici, attività aberrante di rete, alterazioni delle proteine dipendenti da attività neuronale, placche amiloidi, distrofia neuritica, vasculopatia, astrocitosi e microgliosi. Importante, diverse alterazioni molecolari impreviste identificate nei topi transgenici hAPP, sono state convalidate nella condizione umana, incluso l'impoverimento delle subunità del canale di sodio dipendente dal voltaggio negli interneuroni corticali (183), gli svuotamenti di calbindin e EphB2 nelle cellule granulari del giro dentato (42) (136), e aumenti di metenkefalina nell'ippocampo, attivazione di fosfolipasi A2 di gruppo IVA, e collagene VI (38) (126) (161).
A dispetto di queste somiglianze sorprendenti, diverse preoccupazioni sono state sollevate circa la rilevanza di questi modelli nella condizione umana, in parte perché hAPP e Aβ sono sovra-espresse nei topi, ma probabilmente non nella maggior parte dei casi di AD. Tuttavia, la sovraespressione di hAPP e Aβ si verifica anche negli esseri umani con duplicazioni del gene APP, e questo sovraespressione provoca sindromi che somigliano all'AD sporadica (155). Un'altra preoccupazione espressa per i topi hAPP è che la maggior parte delle linee mostrano poca, o nulla, perdita neuronale (2) (105), una chiara differenza con la condizione umana. Questa discrepanza potrebbe rappresentare una vera differenza tra specie ma potrebbe anche suggerire che l'Aβ semplicemente non uccide neuroni in-vivo o che per farlo richiede più tempo della vita normale di un topo.
È stato anche sottolineato che nessuno dei trattamenti che hanno mostrato benefici nei topi hAPP hanno finora mostrato benefici nella condizione umana (105). Come indicato sopra, ci sono numerose ragioni di questo fallimento del farmaco negli esseri umani con AD che non hanno nulla a che fare con le barriere di specie. E' anche vero che la progettazione di molti studi preclinici non è abbastanza rigorosa e sono state fatte delle raccomandazioni ragionevoli per porre rimedio a questo problema (103) (171). Va inoltre notato in questo contesto che la maggior parte dei modelli transgenici mirano a valutare patogeni specifici in isolamento, che è uno dei loro punti di forza, ma potrebbe chiaramente essere una debolezza nella valutazione dei farmaci per l'AD. Puntare a un singolo fattore in una cascata patogenica multifattoriale potrebbe anche portare benefici rilevabili quando questo fattore è isolato in un modello sperimentale, ma non quando è accompagnato da altri copatogeni nella complessa condizione umana.
Diverse ragioni possono spiegare perché i deficit cognitivi possono essere rilevati nei topi hAPP prima della formazione della placca e negli esseri umani presumibilmente solo dopo la formazione della placca, comprese le differenze nella sensibilità dei test cognitivi utilizzati, nella capacità dei topi e degli esseri umani di compensare i deficit dell'ippocampo, e in numerose variabili che influenzano la deposizione di Aβ in placche amiloidi o la formazione di oligomeri Aβ. La formazione di placche e oligomeri Aβ può essere dissociata affidabilmente solo in modelli sperimentali, dove i deficit funzionali hanno dimostrato di essere indipendenti dalla placca (137) (135) (180).
Un altro problema è che l'effetto dell'apoE murino sul metabolismo dell'Aβ differisce chiaramente dall'apoE umano, con particolare riguardo alla deposizione di Aβ, che è più importante nei topi transgenici hAPP che esprimono apoE murino rispetto a quelli che esprimono isoforme apoE umane (15) (92). Rispetto ai topi privi di apoE, sia l'apoE3 che l'apoE4 umani stimolano l'eliminazione di Aβ nel topo, mentre l'apoE murino stimola la deposizione di Aβ (15) (92). Questa differenza ha implicazioni significative per comprendere l'effetto dell'apoE sul metabolismo dell'Aβ e per la validazione e interpretazione degli studi clinici di terapia anti-Aβ. La grande maggioranza di studi preclinici relativi all'Aβ sono stati eseguiti in topi hAPP che esprimono apoE endogeno murino (199). Se l'apoE murino differisce dall'apoE umano per regolare il metabolismo dell'Aβ, i farmaci che funzionano bene nei topi hAPP con apoE murino potrebbero non funzionare bene nei pazienti di AD con apoE umana. I topi hAPP che esprimono le diverse forme di apoE umana possono avere un maggiore valore predittivo.
Conclusioni e prospettive
Spesso non ci sono soluzioni semplici a problemi complessi e l'AD è purtroppo uno di questi casi. Nonostante i progressi in diverse discipline della scienza, della tecnologia e della medicina abbiano contribuito a svelare molti aspetti importanti di questa malattia misteriosa, il campo deve ancora tradurre queste intuizioni in cure più efficaci per l'AD. Noi umilmente presentiamo i seguenti suggerimenti su come questo processo potrebbe essere accelerato.
- Si dovrebbero evitare sperimentazioni cliniche premature e intensificare gli sforzi scientifici per ampliare e approfondire la comprensione delle patobiologia di AD.
- Si dovranno stabilire collegamenti più efficaci tra gli scienziati di base e i ricercatori clinici e tra il mondo accademico e l'industria farmaceutica per accelerare la scoperta e la validazione di potenziali bersagli farmacologici e lo sviluppo di nuove terapie.
- Si dovrebbero diversificare gli forzi di indagine e di sviluppo di farmaci per affrontare appieno la multifattorialità della malattia. E' probabile che saranno più efficaci le terapie combinate con farmaci che mirano diversi fattori causali o modificanti (ad esempio, Aβ, tau e apoE4).
- Bisogna continuare e integrare gli sforzi per conoscere meglio i biomarcatori con approcci più innovativi alla progettazione della sperimentazione clinica.
- Bisogna far pesare il potenziale straordinario della biologia dei sistemi, la medicina personalizzata, la tecnologia delle cellule staminali e la riprogrammazione delle cellule sulla ricerca e sullo sviluppo di farmaci per le condizioni di AD e relative.
Per avere benefici, prima che il previsto aumento dei casi di AD travolga i sistemi sanitari di tutto il mondo, queste azioni dovrebbero essere attuate rapidamente e su larga scala. Sono necessari sforzi concertati a livello globale e risorse considerevoli perchè ciò succeda.
Ringraziamenti
Questo lavoro è stato finanziato dai National Institutes of Health e da un dono della Stephen D. Bechtel, Jr. Foundation. Ringraziamo i colleghi del laboratorio degli autori per le molte discussioni stimolanti su questi argomenti, John Carroll per la preparazione della grafica, e Monica Dela Cruz di l'assistenza amministrativa. LM fa parte del consiglio consultivo scientifico di iPierian e ha ricevuto finanziamenti per la ricerca dalla Bristol-Myers Squibb per un progetto correlato alla tau.
Riferimenti
1-Andrews-Zwilling et al., 2010 Andrews-Zwilling, Y., Bien-Ly, N., Xu, Q., Li, G., Bernardo, A., Yoon, S.Y., Zwilling, D., Yan, T.X., Chen, L., and Huang, Y. (2010). Apolipoprotein E4 causes age- and Tau-dependent impairment of GABAergic interneurons, leading to learning and memory deficits in mice. J. Neurosci. 30, 13707–13717. CrossRef | PubMed
2-Ashe and Zahs, 2010 Ashe, K.H., and Zahs, K.R. (2010). Probing the biology of Alzheimer's disease in mice. Neuron 66, 631–645. Abstract | Full Text | PDF (613 kb) | CrossRef | PubMed
3-Asuni et al., 2007 Asuni, A.A., Boutajangout, A., Quartermain, D., and Sigurdsson, E.M. (2007). Immunotherapy targeting pathological tau conformers in a tangle mouse model reduces brain pathology with associated functional improvements. J. Neurosci. 27, 9115–9129. PubMed
4-Bales et al., 1999 Bales, K.R., Verina, T., Cummins, D.J., Du, Y., Dodel, R.C., Saura, J., Fishman, C.E., DeLong, C.A., Piccardo, P., Petegnief, V., et al. (1999). Apolipoprotein E is essential for amyloid deposition in the APP(V717F) transgenic mouse model of Alzheimer's disease. Proc. Natl. Acad. Sci. USA 96, 15233–15238. CrossRef | PubMed
5-Bales et al., 2009 Bales, K.R., Liu, F., Wu, S., Lin, S., Koger, D., DeLong, C., Hansen, J.C., Sullivan, P.M., and Paul, S.M. (2009). Human APOE isoform-dependent effects on brain beta-amyloid levels in PDAPP transgenic mice. J. Neurosci. 29, 6771–6779. CrossRef | PubMed
6-Ballatore et al., 2007 Ballatore, C., Lee, V.M.-Y., and Trojanowski, J.Q. (2007). Tau-mediated neurodegeneration in Alzheimer's disease and related disorders. Nat. Rev. Neurosci. 8, 663–672. PubMed
7-Bareggi et al., 1982 Bareggi, S.R., Franceschi, M., Bonini, L., Zecca, L., and Smirne, S. (1982). Decreased CSF concentrations of homovanillic acid and gamma-aminobutyric acid in Alzheimer's disease. Age- or disease-related modifications?. Arch. Neurol. 39, 709–712. PubMed
8-Barnes and Yaffe, 2011 Barnes, D.E., and Yaffe, K. (2011). The projected effect of risk factor reduction on Alzheimer's disease prevalence. Lancet Neurol. 10, 819–828. CrossRef | PubMed
9-Bateman et al., 2011 Bateman, R.J., Aisen, P.S., De Strooper, B., Fox, N.C., Lemere, C.A., Ringman, J.M., Salloway, S., Sperling, R.A., Windisch, M., and Xiong, C. (2011). Autosomal-dominant Alzheimer's disease: a review and proposal for the prevention of Alzheimer's disease. Alzheimers Res. Ther. 3, 1. PubMed
10-Benilova et al., 2012 Benilova, I., Karran, E., and De Strooper, B. (2012). The toxic Aβ oligomer and Alzheimer's disease: An emperor in need of clothes. Nat. Neurosci. 15, 349–357. CrossRef | PubMed
11-Berlau et al., 2009 Berlau, D.J., Corrada, M.M., Head, E., and Kawas, C.H. (2009). APOE epsilon2 is associated with intact cognition but increased Alzheimer pathology in the oldest old. Neurology 72, 829–834. CrossRef | PubMed
12-Bero et al., 2011 Bero, A.W., Yan, P., Roh, J.H., Cirrito, J.R., Stewart, F.R., Raichle, M.E., Lee, J.M., and Holtzman, D.M. (2011). Neuronal activity regulates the regional vulnerability to amyloid-β deposition. Nat. Neurosci. 14, 750–756. CrossRef | PubMed
13-Bertram et al., 2010 Bertram, L., Lill, C.M., and Tanzi, R.E. (2010). The genetics of Alzheimer disease: back to the future. Neuron 68, 270–281. Abstract | Full Text | PDF (423 kb) | CrossRef | PubMed
14-Bezprozvanny, 2010 Bezprozvanny, I. (2010). The rise and fall of Dimebon. Drug News Perspect. 23, 518–523. PubMed
15-Bien-Ly et al., 2011 Bien-Ly, N., Andrews-Zwilling, Y., Xu, Q., Bernardo, A., Wang, C., and Huang, Y. (2011). C-terminal-truncated apolipoprotein (apo) E4 inefficiently clears amyloid-β (Abeta) and acts in concert with Abeta to elicit neuronal and behavioral deficits in mice. Proc. Natl. Acad. Sci. USA 108, 4236–4241. CrossRef | PubMed
16-Bien-Ly et al., 2012 Bien-Ly, N., Gillespie, A.K., Walker, D., Yoon, S.Y., and Huang, Y. (2012). Reducing human apolipoprotein E levels attenuates age-dependent Aβ accumulation in mutant human amyloid precursor protein transgenic mice. J. Neurosci. 32, . doi:10.1523/jneurosci.0033-12.2012 | PubMed
17-Bousquet et al., 2011 Bousquet, J., Anto, J.M., Sterk, P.J., Adcock, I.M., Chung, K.F., Roca, J., Agusti, A., Brightling, C., Cambon-Thomsen, A., Cesario, A., et al. (2011). Systems medicine and integrated care to combat chronic noncommunicable diseases. Genome Med. 3, 43. PubMed
18-Braak and Del Tredici, 2011 Braak, H., and Del Tredici, K. (2011). Alzheimer's pathogenesis: is there neuron-to-neuron propagation?. Acta Neuropathol. 121, 589–595. PubMed
19-Braak et al., 2011 Braak, H., Thal, D.R., Ghebremedhin, E., and Del Tredici, K. (2011). Stages of the pathologic process in Alzheimer disease: age categories from 1 to 100 years. J. Neuropathol. Exp. Neurol. 70, 960–969. CrossRef | PubMed
20-Brecht et al., 2004 Brecht, W.J., Harris, F.M., Chang, S., Tesseur, I., Yu, G.-Q., Xu, Q., Dee Fish, J., Wyss-Coray, T., Buttini, M., Mucke, L., et al. (2004). Neuron-specific apolipoprotein e4 proteolysis is associated with increased tau phosphorylation in brains of transgenic mice. J. Neurosci. 24, 2527–2534. CrossRef | PubMed
21-Brennand et al., 2011 Brennand, K.J., Simone, A., Jou, J., Gelboin-Burkhart, C., Tran, N., Sangar, S., Li, Y., Mu, Y., Chen, G., Yu, D., et al. (2011). Modelling schizophrenia using human induced pluripotent stem cells. Nature 473, 221–225. CrossRef | PubMed
22-Brodbeck et al., 2011 Brodbeck, J., McGuire, J., Liu, Z., Meyer-Franke, A., Balestra, M.E., Jeong, D.E., Pleiss, M., McComas, C., Hess, F., Witter, D., et al. (2011). Structure-dependent impairment of intracellular apolipoprotein E4 trafficking and its detrimental effects are rescued by small-molecule structure correctors. J. Biol. Chem. 286, 17217–17226. CrossRef | PubMed
23-Brouwers et al., 2006 Brouwers, N., Sleegers, K., Engelborghs, S., Bogaerts, V., Serneels, S., Kamali, K., Corsmit, E., De Leenheir, E., Martin, J.J., De Deyn, P.P., et al. (2006). Genetic risk and transcriptional variability of amyloid precursor protein in Alzheimer's disease. Brain 129, 2984–2991. CrossRef | PubMed
24-Brunden et al., 2009 Brunden, K.R., Trojanowski, J.Q., and Lee, V.M. (2009). Advances in tau-focused drug discovery for Alzheimer's disease and related tauopathies. Nat. Rev. Drug Discov. 8, 783–793. CrossRef | PubMed
25-Brunden et al., 2010 Brunden, K.R., Zhang, B., Carroll, J., Yao, Y., Potuzak, J.S., Hogan, A.M., Iba, M., James, M.J., Xie, S.X., Ballatore, C., et al. (2010). Epothilone D improves microtubule density, axonal integrity, and cognition in a transgenic mouse model of tauopathy. J. Neurosci. 30, 13861–13866. CrossRef | PubMed
26-Bu, 2009 Bu, G. (2009). Apolipoprotein E and its receptors in Alzheimer's disease: pathways, pathogenesis and therapy. Nat. Rev. Neurosci. 10, 333–344. PubMed
27-Buttini et al., 1999 Buttini, M., Orth, M., Bellosta, S., Akeefe, H., Pitas, R.E., Wyss-Coray, T., Mucke, L., and Mahley, R.W. (1999). Expression of human apolipoprotein E3 or E4 in the brains of Apoe-/- mice: isoform-specific effects on neurodegeneration. J. Neurosci. 19, 4867–4880. PubMed
28-Buttini et al., 2002 Buttini, M., Yu, G.-Q., Shockley, K., Huang, Y., Jones, B., Masliah, E., Mallory, M., Yeo, T., Longo, F.M., and Mucke, L. (2002). Modulation of Alzheimer-like synaptic and cholinergic deficits in transgenic mice by human apolipoprotein E depends on isoform, aging, and overexpression of amyloid β peptides but not on plaque formation. J. Neurosci. 22, 10539–10548. PubMed
29-Buttini et al., 2010 Buttini, M., Masliah, E., Yu, G.Q., Palop, J.J., Chang, S., Bernardo, A., Lin, C., Wyss-Coray, T., Huang, Y., and Mucke, L. (2010). Cellular source of apolipoprotein E4 determines neuronal susceptibility to excitotoxic injury in transgenic mice. Am. J. Pathol. 177, 563–569. CrossRef | PubMed
30-Camandola and Mattson, 2011 Camandola, S., and Mattson, M.P. (2011). Aberrant subcellular neuronal calcium regulation in aging and Alzheimer's disease. Biochim. Biophys. Acta 1813, 965–973. PubMed
31-Campion et al., 1999 Campion, D., Dumanchin, C., Hannequin, D., Dubois, B., Belliard, S., Puel, M., Thomas-Anterion, C., Michon, A., Martin, C., Charbonnier, F., et al. (1999). Early-onset autosomal dominant Alzheimer disease: prevalence, genetic heterogeneity, and mutation spectrum. Am. J. Hum. Genet. 65, 664–670. Abstract | Full Text | PDF (100 kb) | CrossRef | PubMed
32-Caselli et al., 2009 Caselli, R.J., Dueck, A.C., Osborne, D., Sabbagh, M.N., Connor, D.J., Ahern, G.L., Baxter, L.C., Rapcsak, S.Z., Shi, J., Woodruff, B.K., et al. (2009). Longitudinal modeling of age-related memory decline and the APOE epsilon4 effect. N. Engl. J. Med. 361, 255–263. CrossRef | PubMed
33-Caselli et al., 2011 Caselli, R.J., Dueck, A.C., Locke, D.E., Sabbagh, M.N., Ahern, G.L., Rapcsak, S.Z., Baxter, L.C., Yaari, R., Woodruff, B.K., Hoffman-Snyder, C., et al. (2011). Cerebrovascular risk factors and preclinical memory decline in healthy APOE ε4 homozygotes. Neurology 76, 1078–1084. CrossRef | PubMed
34-Castellano et al., 2011 Castellano, J.M., Kim, J., Stewart, F.R., Jiang, H., Demattos, R.B., Patterson, B.W., Fagan, A.M., Morris, J.C., Mawuenyega, K.G., Cruchaga, C., et al. (2011). Human apoE isoforms differentially regulate brain amyloid-{beta} peptide clearance. Sci. Transl. Med. 3, , 89ra57. PubMed
35-Chang et al., 2005 Chang, S., ran Ma, T., Miranda, R.D., Balestra, M.E., Mahley, R.W., and Huang, Y. (2005). Lipid- and receptor-binding regions of apolipoprotein E4 fragments act in concert to cause mitochondrial dysfunction and neurotoxicity. Proc. Natl. Acad. Sci. USA 102, 18694–18699. CrossRef | PubMed
36-Chen et al., 2010 Chen, Y., Durakoglugil, M.S., Xian, X., and Herz, J. (2010). ApoE4 reduces glutamate receptor function and synaptic plasticity by selectively impairing ApoE receptor recycling. Proc. Natl. Acad. Sci. USA 107, 12011–12016. CrossRef | PubMed
37-Chen et al., 2012 Chen, H.K., Liu, Z., Meyer-Franke, A., Brodbeck, J., Miranda, R.D., McGuire, J.G., Pleiss, M.A., Ji, Z.S., Balestra, M.E., Walker, D.W., et al. (2012). Small molecule structure correctors abolish detrimental effects of apolipoprotein e4 in cultured neurons. J. Biol. Chem. 287, 5253–5266. CrossRef | PubMed
38-Cheng et al., 2009 Cheng, J.S., Dubal, D.B., Kim, D.H., Legleiter, J., Cheng, I.H., Yu, G.Q., Tesseur, I., Wyss-Coray, T., Bonaldo, P., and Mucke, L. (2009). Collagen VI protects neurons against Abeta toxicity. Nat. Neurosci. 12, 119–121. CrossRef | PubMed
39-Chin et al., 2004 Chin, J., Palop, J.J., Yu, G.-Q., Kojima, N., Masliah, E., and Mucke, L. (2004). Fyn kinase modulates synaptotoxicity, but not aberrant sprouting, in human amyloid precursor protein transgenic mice. J. Neurosci. 24, 4692–4697. CrossRef | PubMed
40-Chin et al., 2007 Chin, J., Massaro, C.M., Palop, J.J., Thwin, M.T., Yu, G.Q., Bien-Ly, N., Bender, A., and Mucke, L. (2007). Reelin depletion in the entorhinal cortex of human amyloid precursor protein transgenic mice and humans with Alzheimer's disease. J. Neurosci. 27, 2727–2733. CrossRef | PubMed
41-Chouliaras et al., 2010 Chouliaras, L., Rutten, B.P., Kenis, G., Peerbooms, O., Visser, P.J., Verhey, F., van Os, J., Steinbusch, H.W., and van den Hove, D.L. (2010). Epigenetic regulation in the pathophysiology of Alzheimer's disease. Prog. Neurobiol. 90, 498–510. PubMed
42-Cissé et al., 2011 Cissé, M., Halabisky, B., Harris, J.A., Devidze, N., Dubal, D.B., Sun, B., Orr, A., Lotz, G., Kim, D.H., Hamto, P., et al. (2011). Reversing EphB2 depletion rescues cognitive functions in Alzheimer model. Nature 469, 47–52. CrossRef | PubMed
43-Citron, 2010 Citron, M. (2010). Alzheimer's disease: strategies for disease modification. Nat. Rev. Drug Discov. 9, 387–398. CrossRef | PubMed
44-Cohen et al., 2009 Cohen, E., Paulsson, J.F., Blinder, P., Burstyn-Cohen, T., Du, D., Estepa, G., Adame, A., Pham, H.M., Holzenberger, M., Kelly, J.W., et al. (2009). Reduced IGF-1 signaling delays age-associated proteotoxicity in mice. Cell 139, 1157–1169. Abstract | Full Text | PDF (1935 kb) | CrossRef | PubMed
45-Cohen et al., 2011 Cohen, T.J., Guo, J.L., Hurtado, D.E., Kwong, L.K., Mills, I.P., Trojanowski, J.Q., and Lee, V.M. (2011). The acetylation of tau inhibits its function and promotes pathological tau aggregation. Nat. Commun. 2, 252. PubMed
46-Cole and Frautschy, 2010 Cole, G.M., and Frautschy, S.A. (2010). Mechanisms of action of non-steroidal anti-inflammatory drugs for the prevention of Alzheimer's disease. CNS Neurol. Disord. Drug Targets 9, 140–148. PubMed
47-Corder et al., 1993 Corder, E.H., Saunders, A.M., Strittmatter, W.J., Schmechel, D.E., Gaskell, P.C., Small, G.W., Roses, A.D., Haines, J.L., and Pericak-Vance, M.A. (1993). Gene dose of apolipoprotein E type 4 allele and the risk of Alzheimer's disease in late onset families. Science 261, 921–923. PubMed
48-Cummings, 2004 Cummings, J.L. (2004). Alzheimer's disease. N. Engl. J. Med. 351, 56–67. CrossRef | PubMed
49-Cysique and Brew, 2009 Cysique, L.A., and Brew, B.J. (2009). Neuropsychological functioning and antiretroviral treatment in HIV/AIDS: a review. Neuropsychol. Rev. 19, 169–185. CrossRef | PubMed
50-Daviglus et al., 2010 Daviglus, M.L., Bell, C.C., Berrettini, W., Bowen, P.E., Connolly, E.S., Cox, N.J., Dunbar-Jacob, J.M., Granieri, E.C., Hunt, G., McGarry, K., et al. (2010). National Institutes of Health State-of-the-Science Conference statement: preventing alzheimer disease and cognitive decline. Ann. Intern. Med. 153, 176–181. PubMed
51-Day and Sweatt, 2011 Day, J.J., and Sweatt, J.D. (2011). Epigenetic mechanisms in cognition. Neuron 70, 813–829. Abstract | Full Text | PDF (720 kb) | CrossRef | PubMed
52-De Jager et al., 2011 De Jager, P.L., Shulman, J.M., Chibnik, L.B., Keenan, B.T., Raj, T., Wilson, R.S., Yu, L., Leurgans, S.E., Tran, D., Aubin, C., et al.Alzheimer's Disease Neuroimaging Initiative (2011). A genome-wide scan for common variants affecting the rate of age-related cognitive decline. Neurobiol. Aging , doi:10.1016/j.neurobiolaging.2011.09.033 | Published online November 3, 2011. PubMed
53-De Strooper et al., 2010 De Strooper, B., Vassar, R., and Golde, T. (2010). The secretases: enzymes with therapeutic potential in Alzheimer disease. Nat. Rev. Neurol. 6, 99–107. PubMed
54-Deane et al., 2008 Deane, R., Sagare, A., Hamm, K., Parisi, M., Lane, S., Finn, M.B., Holtzman, D.M., and Zlokovic, B.V. (2008). apoE isoform-specific disruption of amyloid beta peptide clearance from mouse brain. J. Clin. Invest. 118, 4002–4013. CrossRef | PubMed
55-Decker et al., 2010 Decker, H., Lo, K.Y., Unger, S.M., Ferreira, S.T., and Silverman, M.A. (2010). Amyloid-beta peptide oligomers disrupt axonal transport through an NMDA receptor-dependent mechanism that is mediated by glycogen synthase kinase 3beta in primary cultured hippocampal neurons. J. Neurosci. 30, 9166–9171. PubMed
56-Dennis et al., 2010 Dennis, N.A., Browndyke, J.N., Stokes, J., Need, A., Burke, J.R., Welsh-Bohmer, K.A., and Cabeza, R. (2010). Temporal lobe functional activity and connectivity in young adult APOE varepsilon4 carriers. Alzheimers Dement. 6, 303–311. PubMed
57-Dickey et al., 2007 Dickey, C.A., Kamal, A., Lundgren, K., Klosak, N., Bailey, R.M., Dunmore, J., Ash, P., Shoraka, S., Zlatkovic, J., Eckman, C.B., et al. (2007). The high-affinity HSP90-CHIP complex recognizes and selectively degrades phosphorylated tau client proteins. J. Clin. Invest. 117, 648–658. CrossRef | PubMed
58-Du et al., 2008 Du, H., Guo, L., Fang, F., Chen, D., Sosunov, A.A., McKhann, G.M., Yan, Y., Wang, C., Zhang, H., Molkentin, J.D., et al. (2008). Cyclophilin D deficiency attenuates mitochondrial and neuronal perturbation and ameliorates learning and memory in Alzheimer's disease. Nat. Med. 14, 1097–1105. CrossRef | PubMed
59-Duce et al., 2010 Duce, J.A., Tsatsanis, A., Cater, M.A., James, S.A., Robb, E., Wikhe, K., Leong, S.L., Perez, K., Johanssen, T., Greenough, M.A., et al. (2010). Iron-export ferroxidase activity of β-amyloid precursor protein is inhibited by zinc in Alzheimer's disease. Cell 142, 857–867. Abstract | Full Text | PDF (1474 kb) | CrossRef | PubMed
60-Dumanis et al., 2009 Dumanis, S.B., Tesoriero, J.A., Babus, L.W., Nguyen, M.T., Trotter, J.H., Ladu, M.J., Weeber, E.J., Turner, R.S., Xu, B., Rebeck, G.W., et al. (2009). ApoE4 decreases spine density and dendritic complexity in cortical neurons in vivo. J. Neurosci. 29, 15317–15322. CrossRef | PubMed
61-Durakoglugil et al., 2009 Durakoglugil, M.S., Chen, Y., White, C.L., Kavalali, E.T., and Herz, J. (2009). Reelin signaling antagonizes beta-amyloid at the synapse. Proc. Natl. Acad. Sci. USA 106, 15938–15943. CrossRef | PubMed
62-Evans et al., 2011 Evans, C.G., Jinwal, U.K., Makley, L.N., Dickey, C.A., and Gestwicki, J.E. (2011). Identification of dihydropyridines that reduce cellular tau levels. Chem. Commun. (Camb.) 47, 529–531. CrossRef | PubMed
63-Farrer et al., 1997 Farrer, L.A., Cupples, L.A., Haines, J.L., Hyman, B., Kukull, W.A., Mayeux, R., Myers, R.H., Pericak-Vance, M.A., Risch, N., and van Duijn, C.M.APOE and Alzheimer Disease Meta Analysis Consortium (1997). Effects of age, sex, and ethnicity on the association between apolipoprotein E genotype and Alzheimer disease. A meta-analysis. JAMA 278, 1349–1356. PubMed
64-Filippini et al., 2009 Filippini, N., MacIntosh, B.J., Hough, M.G., Goodwin, G.M., Frisoni, G.B., Smith, S.M., Matthews, P.M., Beckmann, C.F., and Mackay, C.E. (2009). Distinct patterns of brain activity in young carriers of the APOE-epsilon4 allele. Proc. Natl. Acad. Sci. USA 106, 7209–7214. CrossRef | PubMed
65-Fischer et al., 2007 Fischer, A., Sananbenesi, F., Wang, X., Dobbin, M., and Tsai, L.H. (2007). Recovery of learning and memory is associated with chromatin remodelling. Nature 447, 178–182. CrossRef | PubMed
66-Frisoni et al., 2010 Frisoni, G.B., Fox, N.C., Jack, C.R., Scheltens, P., and Thompson, P.M. (2010). The clinical use of structural MRI in Alzheimer disease. Nat. Rev. Neurol. 6, 67–77. PubMed
67-Galimberti and Scarpini, 2011 Galimberti, D., and Scarpini, E. (2011). Inflammation and oxidative damage in Alzheimer's disease: friend or foe?. Front. Biosci. (Schol. Ed.) 3, 252–266. PubMed
68-Gan and Mucke, 2008 Gan, L., and Mucke, L. (2008). Paths of convergence: sirtuins in aging and neurodegeneration. Neuron 58, 10–14. Abstract | Full Text | PDF (270 kb) | CrossRef | PubMed
69-Genin et al., 2011 Genin, E., Hannequin, D., Wallon, D., Sleegers, K., Hiltunen, M., Combarros, O., Bullido, M.J., Engelborghs, S., De Deyn, P., Berr, C., et al. (2011). APOE and Alzheimer disease: a major gene with semi-dominant inheritance. Mol. Psychiatry 16, 903–907. CrossRef | PubMed
70-Ghosal et al., 2009 Ghosal, K., Vogt, D.L., Liang, M., Shen, Y., Lamb, B.T., and Pimplikar, S.W. (2009). Alzheimer's disease-like pathological features in transgenic mice expressing the APP intracellular domain. Proc. Natl. Acad. Sci. USA 106, 18367–18372. CrossRef | PubMed
71-Giannakopoulos et al., 2003 Giannakopoulos, P., Herrmann, F.R., Bussière, T., Bouras, C., Kövari, E., Perl, D.P., Morrison, J.H., Gold, G., and Hof, P.R. (2003). Tangle and neuron numbers, but not amyloid load, predict cognitive status in Alzheimer's disease. Neurology 60, 1495–1500. PubMed
72-Gibson et al., 2000 Gibson, G.E., Haroutunian, V., Zhang, H., Park, L.C.H., Shi, Q., Lesser, M., Mohs, R.C., Sheu, R.K.F., and Blass, J.P. (2000). Mitochondrial damage in Alzheimer's disease varies with apolipoprotein E genotype. Ann. Neurol. 48, 297–303. CrossRef | PubMed
73-Gilman et al., 2005 Gilman, S., Koller, M., Black, R.S., Jenkins, L., Griffith, S.G., Fox, N.C., Eisner, L., Kirby, L., Rovira, M.B., Forette, F., et al. (2005). Clinical effects of Abeta immunization (AN1792) in patients with AD in an interrupted trial. Neurology 64, 1553–1562. CrossRef | PubMed
74-Giuffrida et al., 2009 Giuffrida, M.L., Caraci, F., Pignataro, B., Cataldo, S., De Bona, P., Bruno, V., Molinaro, G., Pappalardo, G., Messina, A., Palmigiano, A., et al. (2009). Beta-amyloid monomers are neuroprotective. J. Neurosci. 29, 10582–10587. CrossRef | PubMed
75-Golde et al., 2011 Golde, T.E., Schneider, L.S., and Koo, E.H. (2011). Anti-aβ therapeutics in Alzheimer's disease: the need for a paradigm shift. Neuron 69, 203–213. Abstract | Full Text | PDF (363 kb) | CrossRef | PubMed
76-Gómez-Isla et al., 1996 Gómez-Isla, T., Price, J.L., McKeel, D.W., Morris, J.C., Growdon, J.H., and Hyman, B.T. (1996). Profound loss of layer II entorhinal cortex neurons occurs in very mild Alzheimer's disease. J. Neurosci. 16, 4491–4500. PubMed
77-Gozes et al., 2009 Gozes, I., Stewart, A., Morimoto, B., Fox, A., Sutherland, K., and Schmeche, D. (2009). Addressing Alzheimer's disease tangles: from NAP to AL-108. Curr. Alzheimer Res. 6, 455–460. CrossRef | PubMed
78-Green et al., 2009 Green, R.C., Schneider, L.S., Amato, D.A., Beelen, A.P., Wilcock, G., Swabb, E.A., and Zavitz, K.H.Tarenflurbil Phase 3 Study Group (2009). Effect of tarenflurbil on cognitive decline and activities of daily living in patients with mild Alzheimer disease: a randomized controlled trial. JAMA 302, 2557–2564. CrossRef | PubMed
79-Grouselle et al., 1998 Grouselle, D., Winsky-Sommerer, R., David, J.P., Delacourte, A., Dournaud, P., and Epelbaum, J. (1998). Loss of somatostatin-like immunoreactivity in the frontal cortex of Alzheimer patients carrying the apolipoprotein epsilon 4 allele. Neurosci. Lett. 255, 21–24. CrossRef | PubMed
80-Gura, 2008 Gura, T. (2008). Hope in Alzheimer's fight emerges from unexpected places. Nat. Med. 14, 894. CrossRef | PubMed
81-Haan et al., 1999 Haan, M.N., Shemanski, L., Jagust, W.J., Manolio, T.A., and Kuller, L. (1999). The role of APOE epsilon4 in modulating effects of other risk factors for cognitive decline in elderly persons. JAMA 282, 40–46. CrossRef | PubMed
82-Hampel et al., 2010 Hampel, H., Frank, R., Broich, K., Teipel, S.J., Katz, R.G., Hardy, J., Herholz, K., Bokde, A.L., Jessen, F., Hoessler, Y.C., et al. (2010). Biomarkers for Alzheimer's disease: academic, industry and regulatory perspectives. Nat. Rev. Drug Discov. 9, 560–574. CrossRef | PubMed
83-Harris and Rubinsztein, 2011 Harris, H., and Rubinsztein, D.C. (2011). Control of autophagy as a therapy for neurodegenerative disease. Nat. Rev. Neurol. 8, 108–117. PubMed
84-Harris et al., 2003 Harris, F.M., Brecht, W.J., Xu, Q., Tesseur, I., Kekonius, L., Wyss-Coray, T., Fish, J.D., Masliah, E., Hopkins, P.C., Scearce-Levie, K., et al. (2003). Carboxyl-terminal-truncated apolipoprotein E4 causes Alzheimer's disease-like neurodegeneration and behavioral deficits in transgenic mice. Proc. Natl. Acad. Sci. USA 100, 10966–10971. CrossRef | PubMed
85-Harris et al., 2004 Harris, F.M., Tesseur, I., Brecht, W.J., Xu, Q., Mullendorff, K., Chang, S., Wyss-Coray, T., Mahley, R.W., and Huang, Y. (2004). Astroglial regulation of apolipoprotein E expression in neuronal cells. Implications for Alzheimer's disease. J. Biol. Chem. 279, 3862–3868. CrossRef | PubMed
86-Harris et al., 2010 Harris, J.A., Devidze, N., Halabisky, B., Lo, I., Thwin, M.T., Yu, G.Q., Bredesen, D.E., Masliah, E., and Mucke, L. (2010). Many neuronal and behavioral impairments in transgenic mouse models of Alzheimer's disease are independent of caspase cleavage of the amyloid precursor protein. J. Neurosci. 30, 372–381. CrossRef | PubMed
87-Hartman et al., 2001 Hartman, R.E., Wozniak, D.F., Nardi, A., Olney, J.W., Sartorius, L., and Holtzman, D.M. (2001). Behavioral phenotyping of GFAP-apoE3 and -apoE4 transgenic mice: apoE4 mice show profound working memory impairments in the absence of Alzheimer's-like neuropathology. Exp. Neurol. 170, 326–344. CrossRef | PubMed
88-Herrup, 2010 Herrup, K. (2010). Reimagining Alzheimer's disease—an age-based hypothesis. J. Neurosci. 30, 16755–16762. CrossRef | PubMed
89-Higashi et al., 2007 Higashi, S., Iseki, E., Yamamoto, R., Minegishi, M., Hino, H., Fujisawa, K., Togo, T., Katsuse, O., Uchikado, H., Furukawa, Y., et al. (2007). Concurrence of TDP-43, tau and alpha-synuclein pathology in brains of Alzheimer's disease and dementia with Lewy bodies. Brain Res. 1184, 284–294. CrossRef | PubMed
90-Holtzman et al., 1995 Holtzman, D.M., Pitas, R.E., Kilbridge, J., Nathan, B., Mahley, R.W., Bu, G., and Schwartz, A.L. (1995). Low density lipoprotein receptor-related protein mediates apolipoprotein E-dependent neurite outgrowth in a central nervous system-derived neuronal cell line. Proc. Natl. Acad. Sci. USA 92, 9480–9484. CrossRef | PubMed
91-Holtzman et al., 1999 Holtzman, D.M., Bales, K.R., Wu, S., Bhat, P., Parsadanian, M., Fagan, A.M., Chang, L.K., Sun, Y., and Paul, S.M. (1999). Expression of human apolipoprotein E reduces amyloid-β deposition in a mouse model of Alzheimer's disease. J. Clin. Invest. 103, R15–R21. CrossRef | PubMed
92-Holtzman et al., 2000 Holtzman, D.M., Bales, K.R., Tenkova, T., Fagan, A.M., Parsadanian, M., Sartorius, L.J., Mackey, B., Olney, J., McKeel, D., Wozniak, D., et al. (2000). Apolipoprotein E isoform-dependent amyloid deposition and neuritic degeneration in a mouse model of Alzheimer's disease. Proc. Natl. Acad. Sci. USA 97, 2892–2897. CrossRef | PubMed
93-Hoover et al., 2010 Hoover, B.R., Reed, M.N., Su, J., Penrod, R.D., Kotilinek, L.A., Grant, M.K., Pitstick, R., Carlson, G.A., Lanier, L.M., Yuan, L.L., et al. (2010). Tau mislocalization to dendritic spines mediates synaptic dysfunction independently of neurodegeneration. Neuron 68, 1067–1081. Abstract | Full Text | PDF (2703 kb) | CrossRef | PubMed
94-Huang, 2006 Huang, Y. (2006). Molecular and cellular mechanisms of apolipoprotein E4 neurotoxicity and potential therapeutic strategies. Curr. Opin. Drug Discov. Devel. 9, 627–641. PubMed
95-Huang, 2010 Huang, Y. (2010). Abeta-independent roles of apolipoprotein E4 in the pathogenesis of Alzheimer's disease. Trends Mol. Med. 16, 287–294. Abstract | Full Text | PDF (296 kb) | CrossRef | PubMed
96-Iqbal et al., 2010 Iqbal, K., Liu, F., Gong, C.X., and Grundke-Iqbal, I. (2010). Tau in Alzheimer disease and related tauopathies. Curr. Alzheimer Res. 7, 656–664. CrossRef | PubMed
97-Israel et al., 2012 Israel, M.A., Yuan, S.H., Bardy, C., Reyna, S.M., Mu, Y., Herrera, C., Hefferan, M.P., Van Gorp, S., Nazor, K.L., Boscolo, F.S., et al. (2012). Probing sporadic and familial Alzheimer's disease using induced pluripotent stem cells. Nature 482, 216–220. PubMed
98-Ittner and Götz, 2011 Ittner, L.M., and Götz, J. (2011). Amyloid-β and tau—a toxic pas de deux in Alzheimer's disease. Nat. Rev. Neurosci. 12, 65–72. PubMed
99-Jack et al., 2011 Jack, C.R., Albert, M.S., Knopman, D.S., McKhann, G.M., Sperling, R.A., Carrillo, M.C., Thies, B., and Phelps, C.H. (2011). Introduction to the recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 7, 257–262. PubMed
100-Ji et al., 2002 Ji, Z.-S., Miranda, R.D., Newhouse, Y.M., Weisgraber, K.H., Huang, Y., and Mahley, R.W. (2002). Apolipoprotein E4 potentiates amyloid beta peptide-induced lysosomal leakage and apoptosis in neuronal cells. J. Biol. Chem. 277, 21821–21828. CrossRef | PubMed
101-Jo et al., 2011 Jo, J., Whitcomb, D.J., Olsen, K.M., Kerrigan, T.L., Lo, S.C., Bru-Mercier, G., Dickinson, B., Scullion, S., Sheng, M., Collingridge, G., et al. (2011). Aβ(1-42) inhibition of LTP is mediated by a signaling pathway involving caspase-3, Akt1 and GSK-3β. Nat. Neurosci. 14, 545–547. CrossRef | PubMed
102-Jones et al., 2011 Jones, P.B., Adams, K.W., Rozkalne, A., Spires-Jones, T.L., Hshieh, T.T., Hashimoto, T., von Armin, C.A., Mielke, M., Bacskai, B.J., and Hyman, B.T. (2011). Apolipoprotein E: Isoform specific differences in tertiary structure and interaction with amyloid-beta in human Alzheimer brain. PLoS One 6, e14586. PubMed
103-Jucker, 2010 Jucker, M. (2010). The benefits and limitations of animal models for translational research in neurodegenerative diseases. Nat. Med. 16, 1210–1214. CrossRef | PubMed
104-Jucker and Walker, 2011 Jucker, M., and Walker, L.C. (2011). Pathogenic protein seeding in Alzheimer disease and other neurodegenerative disorders. Ann. Neurol. 70, 532–540. CrossRef | PubMed
105-Karran et al., 2011 Karran, E., Mercken, M., and De Strooper, B. (2011). The amyloid cascade hypothesis for Alzheimer's disease: an appraisal for the development of therapeutics. Nat. Rev. Drug Discov. 10, 698–712. CrossRef | PubMed
106-Kim et al., 2009 Kim, J., Basak, J.M., and Holtzman, D.M. (2009). The role of apolipoprotein E in Alzheimer's disease. Neuron 63, 287–303. Abstract | Full Text | PDF (652 kb) | CrossRef | PubMed
107-Kim et al., 2010 Kim, S., Jensen, J.R., Cisek, K., Funk, K.E., Naphade, S., Schafer, K., and Kuret, J. (2010). Imaging as a strategy for premortem diagnosis and staging of tauopathies. Curr. Alzheimer Res. 7, 230–234. CrossRef | PubMed
108-Kim et al., 2011 Kim, J., Jiang, H., Park, S., Eltorai, A.E., Stewart, F.R., Yoon, H., Basak, J.M., Finn, M.B., and Holtzman, D.M. (2011). Haploinsufficiency of human APOE reduces amyloid deposition in a mouse model of amyloid-β amyloidosis. J. Neurosci. 31, 18007–18012. PubMed
109-Koh et al., 2010 Koh, M.T., Haberman, R.P., Foti, S., McCown, T.J., and Gallagher, M. (2010). Treatment strategies targeting excess hippocampal activity benefit aged rats with cognitive impairment. Neuropsychopharmacology 35, 1016–1025. CrossRef | PubMed
110-Koistinaho et al., 2004 Koistinaho, M., Lin, S., Wu, X., Esterman, M., Koger, D., Hanson, J., Higgs, R., Liu, F., Malkani, S., Bales, K.R., et al. (2004). Apolipoprotein E promotes astrocyte colocalization and degradation of deposited amyloid-β peptides. Nat. Med. 10, 719–726. CrossRef | PubMed
111-Kramer et al., 2011 Kramer, P.L., Xu, H., Woltjer, R.L., Westaway, S.K., Clark, D., Erten-Lyons, D., Kaye, J.A., Welsh-Bohmer, K.A., Troncoso, J.C., Markesbery, W.R., et al. (2011). Alzheimer disease pathology in cognitively healthy elderly: a genome-wide study. Neurobiol. Aging 32, 2113–2122. CrossRef | PubMed
112-Lannfelt et al., 2008 Lannfelt, L., Blennow, K., Zetterberg, H., Batsman, S., Ames, D., Harrison, J., Masters, C.L., Targum, S., Bush, A.I., Murdoch, R., et al.PBT2-201-EURO study group (2008). Safety, efficacy, and biomarker findings of PBT2 in targeting Abeta as a modifying therapy for Alzheimer's disease: a phase IIa, double-blind, randomised, placebo-controlled trial. Lancet Neurol. 7, 779–786. CrossRef | PubMed
113-Laskowitz et al., 2007 Laskowitz, D.T., McKenna, S.E., Song, P., Wang, H., Durham, L., Yeung, N., Christensen, D., and Vitek, M.P. (2007). COG1410, a novel apolipoprotein E-based peptide, improves functional recovery in a murine model of traumatic brain injury. J. Neurotrauma 24, 1093–1107. CrossRef | PubMed
114-Lee et al., 2010a Lee, H.P., Zhu, X., Casadesus, G., Castellani, R.J., Nunomura, A., Smith, M.A., Lee, H.G., and Perry, G. (2010). Antioxidant approaches for the treatment of Alzheimer's disease. Expert Rev. Neurother. 10, 1201–1208. CrossRef | PubMed
115-Lee et al., 2010b Lee, K.J., Moussa, C.E., Lee, Y., Sung, Y., Howell, B.W., Turner, R.S., Pak, D.T., and Hoe, H.S. (2010). Beta amyloid-independent role of amyloid precursor protein in generation and maintenance of dendritic spines. Neuroscience 169, 344–356. CrossRef | PubMed
116-Li et al., 2009 Li, G., Bien-Ly, N., Andrews-Zwilling, Y., Xu, Q., Bernardo, A., Ring, K., Halabisky, B., Deng, C., Mahley, R.W., and Huang, Y. (2009). GABAergic interneuron dysfunction impairs hippocampal neurogenesis in adult apolipoprotein E4 knockin mice. Cell Stem Cell 5, 634–645. PubMed
117-Li et al., 2011 Li, S., Jin, M., Koeglsperger, T., Shepardson, N.E., Shankar, G.M., and Selkoe, D.J. (2011). Soluble Aβ oligomers inhibit long-term potentiation through a mechanism involving excessive activation of extrasynaptic NR2B-containing NMDA receptors. J. Neurosci. 31, 6627–6638. CrossRef | PubMed
118-Logue et al., 2011 Logue, M.W., Schu, M., Vardarajan, B.N., Buros, J., Green, R.C., Go, R.C., Griffith, P., Obisesan, T.O., Shatz, R., Borenstein, A., et al.Multi-Institutional Research on Alzheimer Genetic Epidemiology (MIRAGE) Study Group (2011). A comprehensive genetic association study of Alzheimer disease in African Americans. Arch. Neurol. 68, 1569–1579. PubMed
119-Lopez et al., 2009 Lopez, O.L., Becker, J.T., Wahed, A.S., Saxton, J., Sweet, R.A., Wolk, D.A., Klunk, W., and Dekosky, S.T. (2009). Long-term effects of the concomitant use of memantine with cholinesterase inhibition in Alzheimer disease. J. Neurol. Neurosurg. Psychiatry 80, 600–607. CrossRef | PubMed
120-Mahley et al., 2006 Mahley, R.W., Weisgraber, K.H., and Huang, Y. (2006). Apolipoprotein E4: a causative factor and therapeutic target in neuropathology, including Alzheimer's disease. Proc. Natl. Acad. Sci. USA 103, 5644–5651. CrossRef | PubMed
121-Marchetti and Marie, 2011 Marchetti, C., and Marie, H. (2011). Hippocampal synaptic plasticity in Alzheimer's disease: what have we learned so far from transgenic models?. Rev. Neurosci. 22, 373–402. CrossRef | PubMed
122-Masliah et al., 1995 Masliah, E., Mallory, M., Ge, N., Alford, M., Veinbergs, I., and Roses, A.D. (1995). Neurodegeneration in the central nervous system of apoE-deficient mice. Exp. Neurol. 136, 107–122. CrossRef | PubMed
123-Masliah et al., 2001 Masliah, E., Rockenstein, E., Veinbergs, I., Sagara, Y., Mallory, M., Hashimoto, M., and Mucke, L. (2001). β-amyloid peptides enhance α-synuclein accumulation and neuronal deficits in a transgenic mouse model linking Alzheimer's disease and Parkinson's disease. Proc. Natl. Acad. Sci. USA 98, 12245–12250. CrossRef | PubMed
124-Masliah et al., 2005 Masliah, E., Rockenstein, E., Adame, A., Alford, M., Crews, L., Hashimoto, M., Seubert, P., Lee, M., Goldstein, J., Chilcote, T., et al. (2005). Effects of alpha-synuclein immunization in a mouse model of Parkinson's disease. Neuron 46, 857–868. Abstract | Full Text | PDF (792 kb) | CrossRef | PubMed
125-Mawuenyega et al., 2010 Mawuenyega, K.G., Sigurdson, W., Ovod, V., Munsell, L., Kasten, T., Morris, J.C., Yarasheski, K.E., and Bateman, R.J. (2010). Decreased clearance of CNS beta-amyloid in Alzheimer's disease. Science 330, 1774. CrossRef | PubMed
126-Meilandt et al., 2008 Meilandt, W.J., Yu, G.-Q., Chin, J., Roberson, E.D., Palop, J.J., Wu, T., Scearce-Levie, K., and Mucke, L. (2008). Enkephalin elevations contribute to neuronal and behavioral impairments in a transgenic mouse model of Alzheimer's disease. J. Neurosci. 28, 5007–5017. CrossRef | PubMed
127-Millan Sanchez et al., 2011 Millan Sanchez, M., Heyn, S.N., Das, D., Moghadam, S., Martin, K.J., and Salehi, A. (2011). Neurobiological elements of cognitive dysfunction in Down Syndrome: Exploring the role of APP. Biol. Psychiatry 71, 403–409. CrossRef | PubMed
128-Miller et al., 2010 Miller, J.A., Horvath, S., and Geschwind, D.H. (2010). Divergence of human and mouse brain transcriptome highlights Alzheimer disease pathways. Proc. Natl. Acad. Sci. USA 107, 12698–12703. CrossRef | PubMed
129-Miller et al., 2011 Miller, J., Arrasate, M., Brooks, E., Libeu, C.P., Legleiter, J., Hatters, D., Curtis, J., Cheung, K., Krishnan, P., Mitra, S., et al. (2011). Identifying polyglutamine protein species in situ that best predict neurodegeneration. Nat. Chem. Biol. 7, 925–934. CrossRef | PubMed
130-Min et al., 2010 Min, S.W., Cho, S.H., Zhou, Y., Schroeder, S., Haroutunian, V., Seeley, W.W., Huang, E.J., Shen, Y., Masliah, E., Mukherjee, C., et al. (2010). Acetylation of tau inhibits its degradation and contributes to tauopathy. Neuron 67, 953–966. Abstract | Full Text | PDF (1696 kb) | CrossRef | PubMed
131-Morris et al., 2009 Morris, J.C., Roe, C.M., Grant, E.A., Head, D., Storandt, M., Goate, A.M., Fagan, A.M., Holtzman, D.M., and Mintun, M.A. (2009). Pittsburgh compound B imaging and prediction of progression from cognitive normality to symptomatic Alzheimer disease. Arch. Neurol. 66, 1469–1475. CrossRef | PubMed
132-Morris et al., 2011 Morris, M., Maeda, S., Vossel, K., and Mucke, L. (2011). The many faces of tau. Neuron 70, 410–426. Abstract | Full Text | PDF (943 kb) | CrossRef | PubMed
133-Nixon and Yang, 2011 Nixon, R.A., and Yang, D.S. (2011). Autophagy failure in Alzheimer's disease-locating the primary defect. Neurobiol. Dis. 43, 38–45. CrossRef | PubMed
134-Palop and Mucke, 2009 Palop, J.J., and Mucke, L. (2009). Epilepsy and cognitive impairments in Alzheimer disease. Arch. Neurol. 66, 435–440. CrossRef | PubMed
135-Palop and Mucke, 2010 Palop, J.J., and Mucke, L. (2010). Amyloid-beta-induced neuronal dysfunction in Alzheimer's disease: from synapses toward neural networks. Nat. Neurosci. 13, 812–818. CrossRef | PubMed
136-Palop et al., 2003 Palop, J.J., Jones, B., Kekonius, L., Chin, J., Yu, G.-Q., Raber, J., Masliah, E., and Mucke, L. (2003). Neuronal depletion of calcium-dependent proteins in the dentate gyrus is tightly linked to Alzheimer's disease-related cognitive deficits. Proc. Natl. Acad. Sci. USA 100, 9572–9577. CrossRef | PubMed
137-Palop et al., 2006 Palop, J.J., Chin, J., and Mucke, L. (2006). A network dysfunction perspective on neurodegenerative diseases. Nature 443, 768–773. CrossRef | PubMed
138-Peleg et al., 2010 Peleg, S., Sananbenesi, F., Zovoilis, A., Burkhardt, S., Bahari-Javan, S., Agis-Balboa, R.C., Cota, P., Wittnam, J.L., Gogol-Doering, A., Opitz, L., et al. (2010). Altered histone acetylation is associated with age-dependent memory impairment in mice. Science 328, 753–756. CrossRef | PubMed
139-Perry et al., 2010 Perry, V.H., Nicoll, J.A., and Holmes, C. (2010). Microglia in neurodegenerative disease. Nat. Rev. Neurol. 6, 193–201. PubMed
140-Pickford et al., 2008 Pickford, F., Masliah, E., Britschgi, M., Lucin, K., Narasimhan, R., Jaeger, P.A., Small, S., Spencer, B., Rockenstein, E., Levine, B., et al. (2008). The autophagy-related protein beclin 1 shows reduced expression in early Alzheimer disease and regulates amyloid beta accumulation in mice. J. Clin. Invest. 118, 2190–2199. PubMed
141-Prasher et al., 1998 Prasher, V.P., Farrer, M.J., Kessling, A.M., Fisher, E.M.C., West, R.J., Barber, P.C., and Butler, A.C. (1998). Molecular mapping of Alzheimer-type dementia in Down's syndrome. Ann. Neurol. 43, 380–383. CrossRef | PubMed
142-Putcha et al., 2011 Putcha, D., Brickhouse, M., O'Keefe, K., Sullivan, C., Rentz, D., Marshall, G., Dickerson, B., and Sperling, R. (2011). Hippocampal hyperactivation associated with cortical thinning in Alzheimer's disease signature regions in non-demented elderly adults. J. Neurosci. 31, 17680–17688. PubMed
143-Puzzo et al., 2011 Puzzo, D., Privitera, L., Fa', M., Staniszewski, A., Hashimoto, G., Aziz, F., Sakurai, M., Ribe, E.M., Troy, C.M., Mercken, M., et al. (2011). Endogenous amyloid-β is necessary for hippocampal synaptic plasticity and memory. Ann. Neurol. 69, 819–830. CrossRef | PubMed
144-Querfurth and LaFerla, 2010 Querfurth, H.W., and LaFerla, F.M. (2010). Alzheimer's disease. N. Engl. J. Med. 362, 329–344. CrossRef | PubMed
145-Raber et al., 1998 Raber, J., Wong, D., Buttini, M., Orth, M., Bellosta, S., Pitas, R.E., Mahley, R.W., and Mucke, L. (1998). Isoform-specific effects of human apolipoprotein E on brain function revealed in ApoE knockout mice: increased susceptibility of females. Proc. Natl. Acad. Sci. USA 95, 10914–10919. CrossRef | PubMed
146-Raber et al., 2000 Raber, J., Wong, D., Yu, G.-Q., Buttini, M., Mahley, R.W., Pitas, R.E., and Mucke, L. (2000). Apolipoprotein E and cognitive performance. Nature 404, 352–354. CrossRef | PubMed
147-Raber et al., 2002 Raber, J., Bongers, G., LeFevour, A., Buttini, M., and Mucke, L. (2002). Androgens protect against apolipoprotein E4-induced cognitive deficits. J. Neurosci. 22, 5204–5209. PubMed
148-Reddy et al., 2011 Reddy, M.M., Wilson, R., Wilson, J., Connell, S., Gocke, A., Hynan, L., German, D., and Kodadek, T. (2011). Identification of candidate IgG biomarkers for Alzheimer's disease via combinatorial library screening. Cell 144, 132–142. Abstract | Full Text | PDF (1233 kb) | CrossRef | PubMed
149-Reiman et al., 2011 Reiman, E.M., Langbaum, J.B., Fleisher, A.S., Caselli, R.J., Chen, K., Ayutyanont, N., Quiroz, Y.T., Kosik, K.S., Lopera, F., and Tariot, P.N. (2011). Alzheimer's Prevention Initiative: a plan to accelerate the evaluation of presymptomatic treatments. J. Alzheimers Dis. 26, (Suppl 3) 321–329. PubMed
150-Remes et al., 2008 Remes, A.M., Laru, L., Tuominen, H., Aalto, S., Kemppainen, N., Mononen, H., Någren, K., Parkkola, R., and Rinne, J.O. (2008). Carbon 11-labeled pittsburgh compound B positron emission tomographic amyloid imaging in patients with APP locus duplication. Arch. Neurol. 65, 540–544. CrossRef | PubMed
151-Renner et al., 2010 Renner, M., Lacor, P.N., Velasco, P.T., Xu, J., Contractor, A., Klein, W.L., and Triller, A. (2010). Deleterious effects of amyloid beta oligomers acting as an extracellular scaffold for mGluR5. Neuron 66, 739–754. Abstract | Full Text | PDF (1623 kb) | CrossRef | PubMed
152-Riddell et al., 2008 Riddell, D.R., Zhou, H., Atchison, K., Warwick, H.K., Atkinson, P.J., Jefferson, J., Xu, L., Aschmies, S., Kirksey, Y., Hu, Y., et al. (2008). Impact of apolipoprotein E (ApoE) polymorphism on brain ApoE levels. J. Neurosci. 28, 11445–11453. CrossRef | PubMed
153-Rönicke et al., 2011 Rönicke, R., Mikhaylova, M., Rönicke, S., Meinhardt, J., Schröder, U.H., Fändrich, M., Reiser, G., Kreutz, M.R., and Reymann, K.G. (2011). Early neuronal dysfunction by amyloid β oligomers depends on activation of NR2B-containing NMDA receptors. Neurobiol. Aging 32, 2219–2228. CrossRef | PubMed
154-Rosendorff et al., 2007 Rosendorff, C., Beeri, M.S., and Silverman, J.M. (2007). Cardiovascular risk factors for Alzheimer's disease. Am. J. Geriatr. Cardiol. 16, 143–149. CrossRef | PubMed
155-Rovelet-Lecrux et al., 2006 Rovelet-Lecrux, A., Hannequin, D., Raux, G., Le Meur, N., Laquerrière, A., Vital, A., Dumanchin, C., Feuillette, S., Brice, A., Vercelletto, M., et al. (2006). APP locus duplication causes autosomal dominant early-onset Alzheimer disease with cerebral amyloid angiopathy. Nat. Genet. 38, 24–26. CrossRef | PubMed
156-Sadowski et al., 2006 Sadowski, M.J., Pankiewicz, J., Scholtzova, H., Mehta, P.D., Prelli, F., Quartermain, D., and Wisniewski, T. (2006). Blocking the apolipoprotein E/amyloid-beta interaction as a potential therapeutic approach for Alzheimer's disease. Proc. Natl. Acad. Sci. USA 103, 18787–18792. CrossRef | PubMed
157-Sahara et al., 2005 Sahara, N., Murayama, M., Mizoroki, T., Urushitani, M., Imai, Y., Takahashi, R., Murata, S., Tanaka, K., and Takashima, A. (2005). In vivo evidence of CHIP up-regulation attenuating tau aggregation. J. Neurochem. 94, 1254–1263. CrossRef | PubMed
158-Sahara et al., 2007 Sahara, N., Maeda, S., Yoshiike, Y., Mizoroki, T., Yamashita, S., Murayama, M., Park, J.M., Saito, Y., Murayama, S., and Takashima, A. (2007). Molecular chaperone-mediated tau protein metabolism counteracts the formation of granular tau oligomers in human brain. J. Neurosci. Res. 85, 3098–3108. CrossRef | PubMed
159-Salloway et al., 2009 Salloway, S., Sperling, R., Gilman, S., Fox, N.C., Blennow, K., Raskind, M., Sabbagh, M., Honig, L.S., Doody, R., van Dyck, C.H., et al.Bapineuzumab 201 Clinical Trial Investigators (2009). A phase 2 multiple ascending dose trial of bapineuzumab in mild to moderate Alzheimer disease. Neurology 73, 2061–2070. CrossRef | PubMed
160-Salloway et al., 2011 Salloway, S., Sperling, R., Keren, R., Porsteinsson, A.P., van Dyck, C.H., Tariot, P.N., Gilman, S., Arnold, D., Abushakra, S., Hernandez, C., et al.ELND005-AD201 Investigators (2011). A phase 2 randomized trial of ELND005, scyllo-inositol, in mild to moderate Alzheimer disease. Neurology 77, 1253–1262. CrossRef | PubMed
161-Sanchez-Mejia et al., 2008 Sanchez-Mejia, R.O., Newman, J.W., Toh, S., Yu, G.Q., Zhou, Y., Halabisky, B., Cissé, M., Scearce-Levie, K., Cheng, I.H., Gan, L., et al. (2008). Phospholipase A2 reduction ameliorates cognitive deficits in a mouse model of Alzheimer's disease. Nat. Neurosci. 11, 1311–1318. CrossRef | PubMed
162-Sarantseva et al., 2009 Sarantseva, S., Timoshenko, S., Bolshakova, O., Karaseva, E., Rodin, D., Schwarzman, A.L., and Vitek, M.P. (2009). Apolipoprotein E-mimetics inhibit neurodegeneration and restore cognitive functions in a transgenic Drosophila model of Alzheimer's disease. PLoS ONE 4, e8191. PubMed
163-Sastre et al., 2011 Sastre, M., Richardson, J.C., Gentleman, S.M., and Brooks, D.J. (2011). Inflammatory risk factors and pathologies associated with Alzheimer's disease. Curr. Alzheimer Res. 8, 132–141. PubMed
164-Schenk et al., 1999 Schenk, D., Barbour, R., Dunn, W., Gordon, G., Grajeda, H., Guido, T., Hu, K., Huang, J., Johnson-Wood, K., Khan, K., et al. (1999). Immunization with amyloid-β attenuates Alzheimer-disease-like pathology in the PDAPP mouse. Nature 400, 173–177. CrossRef | PubMed
165-Schirmer et al., 2011 Schirmer, R.H., Adler, H., Pickhardt, M., and Mandelkow, E. (2011). “Lest we forget you—methylene blue…”. Neurobiol. Aging 32, , 2325, e7–e16. PubMed
166-Schor, 2011 Schor, N.F. (2011). What the halted phase III γ-secretase inhibitor trial may (or may not) be telling us. Ann. Neurol. 69, 237–239. CrossRef | PubMed
167-Sharp and Gatz, 2011 Sharp, E.S., and Gatz, M. (2011). Relationship between education and dementia: an updated systematic review. Alzheimer Dis. Assoc. Disord. 25, 289–304. CrossRef | PubMed
168-Shaw et al., 2007 Shaw, P., Lerch, J.P., Pruessner, J.C., Taylor, K.N., Rose, A.B., Greenstein, D., Clasen, L., Evans, A., Rapoport, J.L., and Giedd, J.N. (2007). Cortical morphology in children and adolescents with different apolipoprotein E gene polymorphisms: an observational study. Lancet Neurol. 6, 494–500. CrossRef | PubMed
169-Sheng and Cai, 2012 Sheng, Z.H., and Cai, Q. (2012). Mitochondrial transport in neurons: impact on synaptic homeostasis and neurodegeneration. Nat. Rev. Neurosci. 13, 77–93. PubMed
170-Shimada et al., 2011 Shimada, H., Ataka, S., Tomiyama, T., Takechi, H., Mori, H., and Miki, T. (2011). Clinical course of patients with familial early-onset Alzheimer's disease potentially lacking senile plaques bearing the E693Delta mutation in amyloid precursor protein. Dement. Geriatr. Cogn. Disord. 32, 45–54. CrossRef | PubMed
171-Shineman et al., 2011 Shineman, D.W., Basi, G.S., Bizon, J.L., Colton, C.A., Greenberg, B.D., Hollister, B.A., Lincecum, J., Leblanc, G.G., Lee, L.B., Luo, F., et al. (2011). Accelerating drug discovery for Alzheimer's disease: best practices for preclinical animal studies. Alzheimers Res. Ther. 3, 28. PubMed
172-Shumaker et al., 2003 Shumaker, S.A., Legault, C., Rapp, S.R., Thal, L., Wallace, R.B., Ockene, J.K., Hendrix, S.L., Jones, B.N., Assaf, A.R., Jackson, R.D., et al.WHIMS Investigators (2003). Estrogen plus progestin and the incidence of dementia and mild cognitive impairment in postmenopausal women: the Women's Health Initiative Memory Study: a randomized controlled trial. JAMA 289, 2651–2662. CrossRef | PubMed
173-Sigurdsson, 2009 Sigurdsson, E.M. (2009). Tau-focused immunotherapy for Alzheimer's disease and related tauopathies. Curr. Alzheimer Res. 6, 446–450. CrossRef | PubMed
174-Simón et al., 2009 Simón, A.M., Schiapparelli, L., Salazar-Colocho, P., Cuadrado-Tejedor, M., Escribano, L., López de Maturana, R., Del Río, J., Pérez-Mediavilla, A., and Frechilla, D. (2009). Overexpression of wild-type human APP in mice causes cognitive deficits and pathological features unrelated to Abeta levels. Neurobiol. Dis. 33, 369–378. CrossRef | PubMed
175-Small et al., 2000 Small, G.W., Ercoli, L.M., Silverman, D.H.S., Huang, S.C., Komo, S., Bookheimer, S.Y., Lavretsky, H., Miller, K., Siddarth, P., Rasgon, N.L., et al. (2000). Cerebral metabolic and cognitive decline in persons at genetic risk for Alzheimer's disease. Proc. Natl. Acad. Sci. USA 97, 6037–6042. CrossRef | PubMed
176-Sperling et al., 2010 Sperling, R.A., Dickerson, B.C., Pihlajamaki, M., Vannini, P., LaViolette, P.S., Vitolo, O.V., Hedden, T., Becker, J.A., Rentz, D.M., Selkoe, D.J., et al. (2010). Functional alterations in memory networks in early Alzheimer's disease. Neuromolecular Med. 12, 27–43. CrossRef | PubMed
177-Sperling et al., 2011b Sperling, R.A., Jack, C.R., Black, S.E., Frosch, M.P., Greenberg, S.M., Hyman, B.T., Scheltens, P., Carrillo, M.C., Thies, W., Bednar, M.M., et al. (2011). Amyloid-related imaging abnormalities in amyloid-modifying therapeutic trials: recommendations from the Alzheimer's Association Research Roundtable Workgroup. Alzheimers Dement. 7, 367–385. PubMed
178-Srikanth et al., 2011 Srikanth, V., Maczurek, A., Phan, T., Steele, M., Westcott, B., Juskiw, D., and Münch, G. (2011). Advanced glycation endproducts and their receptor RAGE in Alzheimer's disease. Neurobiol. Aging 32, 763–777. CrossRef | PubMed
179-Taniguchi et al., 2005 Taniguchi, S., Suzuki, N., Masuda, M., Hisanaga, S., Iwatsubo, T., Goedert, M., and Hasegawa, M. (2005). Inhibition of heparin-induced tau filament formation by phenothiazines, polyphenols, and porphyrins. J. Biol. Chem. 280, 7614–7623. CrossRef | PubMed
180-Tomiyama et al., 2010 Tomiyama, T., Matsuyama, S., Iso, H., Umeda, T., Takuma, H., Ohnishi, K., Ishibashi, K., Teraoka, R., Sakama, N., Yamashita, T., et al. (2010). A mouse model of amyloid beta oligomers: their contribution to synaptic alteration, abnormal tau phosphorylation, glial activation, and neuronal loss in vivo. J. Neurosci. 30, 4845–4856. CrossRef | PubMed
181-Van Den Heuvel et al., 2007 Van Den Heuvel, C., Thornton, E., and Vink, R. (2007). Traumatic brain injury and Alzheimer's disease: a review. Prog. Brain Res. 161, 303–316. CrossRef | PubMed
182-Vepsäläinen et al., 2007 Vepsäläinen, S., Helisalmi, S., Koivisto, A.M., Tapaninen, T., Hiltunen, M., and Soininen, H. (2007). Somatostatin genetic variants modify the risk for Alzheimer's disease among Finnish patients. J. Neurol. 254, 1504–1508. CrossRef | PubMed
183-Verret et al., 2012 Verret, L., Mann, E.O., Hang, G.B., Barth, A.M.I., Cobos, I., Ho, K., Devidze, N., Masliah, E., Kreitzer, A.C., Mody, I., et al. (2012). Key role of interneuronal impairments in Alzheimer's disease-related neural network and cognitive dysfunction. Cell 149, , doi:10.1016/j.cell.2012.02.046 | Published online April 26, 2012. PubMed
184-Villeda et al., 2011 Villeda, S.A., Luo, J., Mosher, K.I., Zou, B., Britschgi, M., Bieri, G., Stan, T.M., Fainberg, N., Ding, Z., Eggel, A., et al. (2011). The ageing systemic milieu negatively regulates neurogenesis and cognitive function. Nature 477, 90–94. CrossRef | PubMed
185-Villemagne et al., 2009 Villemagne, V.L., Ataka, S., Mizuno, T., Brooks, W.S., Wada, Y., Kondo, M., Jones, G., Watanabe, Y., Mulligan, R., Nakagawa, M., et al. (2009). High striatal amyloid beta-peptide deposition across different autosomal Alzheimer disease mutation types. Arch. Neurol. 66, 1537–1544. CrossRef | PubMed
186-Vossel et al., 2010 Vossel, K.A., Zhang, K., Brodbeck, J., Daub, A.C., Sharma, P., Finkbeiner, S., Cui, B., and Mucke, L. (2010). Tau reduction prevents Abeta-induced defects in axonal transport. Science 330, 198. CrossRef | PubMed
187-Vossel et al., 2012 Vossel, K., Bien-Ly, N., Bernardo, A., Rascovsky, K., Karydas, A., Rabinovici, G., Sidhu, M., Huang, E., Miller, B., Huang, Y., et al. (2012). ApoE and TDP-43 neuropathology in two siblings with familial FTLD-motor neuron disease. Neurocase . doi:10.1080/13554794.2012.667124 | PubMed
188-Vulih-Shultzman et al., 2007 Vulih-Shultzman, I., Pinhasov, A., Mandel, S., Grigoriadis, N., Touloumi, O., Pittel, Z., and Gozes, I. (2007). Activity-dependent neuroprotective protein snippet NAP reduces tau hyperphosphorylation and enhances learning in a novel transgenic mouse model. J. Pharmacol. Exp. Ther. 323, 438–449. CrossRef | PubMed
189-Weyer et al., 2011 Weyer, S.W., Klevanski, M., Delekate, A., Voikar, V., Aydin, D., Hick, M., Filippov, M., Drost, N., Schaller, K.L., Saar, M., et al. (2011). APP and APLP2 are essential at PNS and CNS synapses for transmission, spatial learning and LTP. EMBO J. 30, 2266–2280. CrossRef | PubMed
190-Wimo and Prince, 2010 Wimo, A., and Prince, M. (2010). World Alzheimer Report 2010: The Global Economic Impact of Dementia. (London: Alzheimer's Disease International), pp. 1–56. PubMed
191-Winner et al., 2011 Winner, B., Jappelli, R., Maji, S.K., Desplats, P.A., Boyer, L., Aigner, S., Hetzer, C., Loher, T., Vilar, M., Campioni, S., et al. (2011). In vivo demonstration that alpha-synuclein oligomers are toxic. Proc. Natl. Acad. Sci. USA 108, 4194–4199. CrossRef | PubMed
192-Wu et al., 2011 Wu, J., Petralia, R.S., Kurushima, H., Patel, H., Jung, M.Y., Volk, L., Chowdhury, S., Shepherd, J.D., Dehoff, M., Li, Y., et al. (2011). Arc/Arg3.1 regulates an endosomal pathway essential for activity-dependent β-amyloid generation. Cell 147, 615–628. Abstract | Full Text | PDF (2651 kb) | CrossRef | PubMed
193-Xu et al., 2006 Xu, Q., Bernardo, A., Walker, D., Kanegawa, T., Mahley, R.W., and Huang, Y. (2006). Profile and regulation of apolipoprotein E (ApoE) expression in the CNS in mice with targeting of green fluorescent protein gene to the ApoE locus. J. Neurosci. 26, 4985–4994. CrossRef | PubMed
194-Xu et al., 2008 Xu, Q., Walker, D., Bernardo, A., Brodbeck, J., Balestra, M.E., and Huang, Y. (2008). Intron-3 retention/splicing controls neuronal expression of apolipoprotein E in the CNS. J. Neurosci. 28, 1452–1459. CrossRef | PubMed
195-Yang et al., 2009 Yang, L., Wang, Z., Wang, B., Justice, N.J., and Zheng, H. (2009). Amyloid precursor protein regulates Cav1.2 L-type calcium channel levels and function to influence GABAergic short-term plasticity. J. Neurosci. 29, 15660–15668. CrossRef | PubMed
196-Yang et al., 2011a Yang, D.S., Stavrides, P., Mohan, P.S., Kaushik, S., Kumar, A., Ohno, M., Schmidt, S.D., Wesson, D.W., Bandyopadhyay, U., Jiang, Y., et al. (2011). Therapeutic effects of remediating autophagy failure in a mouse model of Alzheimer disease by enhancing lysosomal proteolysis. Autophagy 7, 788–789. CrossRef | PubMed
197-Yang et al., 2011b Yang, J., Ji, Y., Mehta, P., Bates, K.A., Sun, Y., and Wisniewski, T. (2011). Blocking the apolipoprotein E/amyloid-β interaction reduces fibrillar vascular amyloid deposition and cerebral microhemorrhages in TgSwDI mice. J. Alzheimers Dis. 24, 269–285. PubMed
198-Ye et al., 2005 Ye, S., Huang, Y., Müllendorff, K., Dong, L., Giedt, G., Meng, E.C., Cohen, F.E., Kuntz, I.D., Weisgraber, K.H., and Mahley, R.W. (2005). Apolipoprotein (apo) E4 enhances amyloid β peptide production in cultured neuronal cells: apoE structure as a potential therapeutic target. Proc. Natl. Acad. Sci. USA 102, 18700–18705. CrossRef | PubMed
199-Zahs and Ashe, 2010 Zahs, K.R., and Ashe, K.H. (2010). ‘Too much good news’ - are Alzheimer mouse models trying to tell us how to prevent, not cure, Alzheimer's disease?. Trends Neurosci. 33, 381–389. Abstract | Full Text | PDF (390 kb) | CrossRef | PubMed
200-Zempel et al., 2010 Zempel, H., Thies, E., Mandelkow, E., and Mandelkow, E.M. (2010). Abeta oligomers cause localized Ca(2+) elevation, missorting of endogenous Tau into dendrites, Tau phosphorylation, and destruction of microtubules and spines. J. Neurosci. 30, 11938–11950. CrossRef | PubMed
201-Zhang et al., 2005 Zhang, B., Maiti, A., Shively, S., Lakhani, F., McDonald-Jones, G., Bruce, J., Lee, E.B., Xie, S.X., Joyce, S., Li, C., et al. (2005). Microtubule-binding drugs offset tau sequestration by stabilizing microtubules and reversing fast axonal transport deficits in a tauopathy model. Proc. Natl. Acad. Sci. USA 102, 227–231. CrossRef | PubMed
202-Zhong and Weisgraber, 2009 Zhong, N., and Weisgraber, K.H. (2009). Understanding the association of apolipoprotein E4 with Alzheimer disease: clues from its structure. J. Biol. Chem. 284, 6027–6031. CrossRef | PubMed
************************
Autori: Yadong Huang & Lennart Mucke, Gladstone Institute of Neurological Disease, San Francisco, CA 94158, USA & Dipartimento di Neurologia, Università di California, San Francisco, CA 94158, USA
Fonte: Cell (> English text) - Traduzione di Franco Pellizzari. - Scarica il file originale in .pdf - in Inglese
Riferimenti: Yadong Huang, Lennart Mucke. Alzheimer Mechanisms and Therapeutic Strategies. Cell, Volume 148, Issue 6, 1204-1222, 16 March 2012, doi:10.1016/j.cell.2012.02.040. Copyright © 2012 Elsevier Inc. All rights reserved.
Copyright: Tutti i diritti di eventuali testi o marchi citati nell'articolo sono riservati ai rispettivi proprietari.
Liberatoria: Questo articolo non propone terapie o diete; per qualsiasi modifica della propria cura o regime alimentare si consiglia di rivolgersi a un medico o dietologo. Il contenuto non dipende da, nè impegna l'Associazione Alzheimer onlus di Riese Pio X. I siti terzi raggiungibili da eventuali links contenuti nell'articolo e/o dagli annunci pubblicitari proposti da Google sono completamente estranei all'Associazione, il loro accesso e uso è a discrezione dell'utente. Liberatoria completa qui.
Nota: L'articolo potrebbe riferire risultati di ricerche mediche, psicologiche, scientifiche o sportive che riflettono lo stato delle conoscenze raggiunte fino alla data della loro pubblicazione.
| Sostieni l'Associazione; una donazione, anche minima, ci aiuterà ad assistere malati e famiglie e continuare ad informarti. Clicca qui a destra: |

 Associazione Alzheimer OdV
Associazione Alzheimer OdV